题目内容
10.有A、B、C、D四种有机物,均由碳、氢、氧三种元素组成.A、B的实验式相同,B、C互为同分异构体,D在一定条件下可以转化为B、C.常温常压下,A是气体,B、C、D是固体,四种物质均易溶于水,A、B可发生银镜反应,B的相对分子质量是A的6倍.(1)写出有机物的名称:A甲醛、C果糖、D蔗糖.
(2)B的结构简式为HOCH2(CHOH)4CHO.
(3)写出D的一种同分异构体发生水解反应的化学方程式:C12H22O11(麦芽糖)+H2O$\stackrel{催化剂}{→}$2C6H12O6(葡萄糖).
分析 由C、H、O组成的有机物中仅有HCHO(甲醛)在常温下是气体,则A是甲醛;A、B的实验式相同,A、B可发生银镜反应,B的相对分子质量是A的6倍,其分子式为C6H12O6,B应是葡萄糖,而B、C互为同分异构体,则C是果糖;D在一定条件下可以转化为B、C,则D为蔗糖.
解答 解:由C、H、O组成的有机物中仅有HCHO(甲醛)在常温下是气体,则A是甲醛;A、B的实验式相同,A、B可发生银镜反应,B的相对分子质量是A的6倍,其分子式为C6H12O6,B应是葡萄糖,而B、C互为同分异构体,则C是果糖;D在一定条件下可以转化为B、C,则D为蔗糖.
(1)由上述分析可知,A为甲醛,C为果糖,D为蔗糖,故答案为:甲醛;果糖;蔗糖;
(2)B为葡萄糖,结构简式为HOCH2(CHOH)4CHO,故答案为:HOCH2(CHOH)4CHO;
(3)D为蔗糖,它的同分异构体是麦芽糖,其水解反应的化学方程式:C12H22O11(麦芽糖)+H2O$\stackrel{催化剂}{→}$2C6H12O6(葡萄糖),
故答案为:C12H22O11(麦芽糖)+H2O$\stackrel{催化剂}{→}$2C6H12O6(葡萄糖).
点评 本题考查有机物推断,关键是确定A是甲醛,再结合物质的性质进行推断,需要学生熟练掌握常见有机物的性质,难度不大.

练习册系列答案
相关题目
20.已知锌能溶解在NaOH溶液中,产生H2.某同学据此设计了测定镀锌铁皮锌镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放人6mol.L-1NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,得质量为m2.下列说法正确的是( )
| A. | 设锌镀层厚度为h,锌的密度为ρ,则h=$\frac{{m}_{1}-{m}_{2}}{ρs}$ | |
| B. | 锌电极的电极反应式为2H2O+2e-═H2↑+2OH- | |
| C. | 锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨 | |
| D. | 当石墨上不再有气泡时,立即取出铁片,冲洗后用酒精灯加热烘干,铁片可能部分被氧化,导致实验结果偏低 |
18.某硫酸溶液的物质的量浓度为xmol/L,溶质的质量分数为a%,则该溶液的密度为( )
| A. | $\frac{1000a%}{98x}$g/ml | B. | $\frac{x}{98a%}$g/mol | C. | $\frac{98x}{a%}$g/ml | D. | $\frac{98x}{10a}$g/mol |
12.如图为雾霾的主要成分示意图.下列说法不正确的是( )
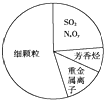

| A. | SO2和NxOy都属于酸性氧化物 | |
| B. | 雾属于胶体,能产生丁达尔效应 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
9.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2、sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶
胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2、sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶
胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
10.如图所示装置选用下列药品,可完成的实验是( )


| A. | 用浓硫酸和铜制取二氧化硫 | B. | 用锌粒与稀硫酸反应制取氢气 | ||
| C. | 用氯化铵与氢氧化钙反应制取氨气 | D. | 用铜与浓硝酸反应制取二氧化氮 |
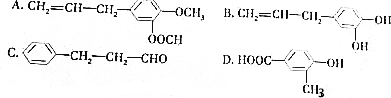
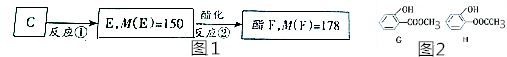
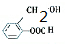 、
、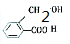 .
.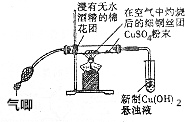 在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.
在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点. 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.