题目内容
按要求完成下列各题.
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中,其负极是 ,负极反应式为 ;正极反应式为 .
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(3)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,则该溶液的pH为 .
(4)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2?2H2O晶体,加入 ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2?2H2O晶体.
(5)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示).由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是 .
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中,其负极是
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,则该溶液的pH为
(4)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2?2H2O晶体,加入
(5)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是
考点:金属的电化学腐蚀与防护,盐类水解的应用,酸碱混合时的定性判断及有关ph的计算,物质的分离、提纯和除杂
专题:基本概念与基本理论
分析:(1)钢铁混有少量的碳杂质,在潮湿的空气中容易形成原电池,中性或弱酸性条件下,钢铁发生吸氧腐蚀,酸性环境下,钢铁发生析氢腐蚀,无论析氢腐蚀、还是吸氧腐蚀,负极上都是铁失电子发生氧化反应,析氢腐蚀,正极上氢离子得电子发生还原反应,吸氧腐蚀正极上氧气得电子发生还原反应;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)依据溶液中的离子积常数结合溶液中氢离子浓度计算溶液pH;
(4)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质;
(5)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解.
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)依据溶液中的离子积常数结合溶液中氢离子浓度计算溶液pH;
(4)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质;
(5)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解.
解答:
解:(1)钢铁在空气酸度不大的环境中,形成原电池发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应,负极上铁电极反应式为:2Fe-4e-═2Fe2+,正极碳上氧气得电子发生还原反应,电极反应式为:O2+2H20+4e-═40H-,
故答案为:Fe;2Fe-4e-═2Fe2+;O2+2H2O+4e-═4OH-;
(2)在25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1,
故答案为:10:1;
(3)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,则该溶液的pH依据溶液中氢离子浓度计算为pH=-lg[H+]=-lg10-4mol/L=4;
故答案为:4;
(4)为得到纯净的CuCl2?2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是氢氧化铜或碱式碳酸铜;
故答案为:Cu(OH)2或Cu2(OH)2CO3 ;
(5)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,2CuCl2?2H2O
Cu(OH)2?CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2?2H2O晶体在干燥的HCl气流中加热脱水,
故答案为:2CuCl2?2H2O
Cu(OH)2?CuCl2+2HCl+2H2O,在干燥的HCl气流中加热脱水.
故答案为:Fe;2Fe-4e-═2Fe2+;O2+2H2O+4e-═4OH-;
(2)在25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1,
故答案为:10:1;
(3)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,则该溶液的pH依据溶液中氢离子浓度计算为pH=-lg[H+]=-lg10-4mol/L=4;
故答案为:4;
(4)为得到纯净的CuCl2?2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是氢氧化铜或碱式碳酸铜;
故答案为:Cu(OH)2或Cu2(OH)2CO3 ;
(5)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,2CuCl2?2H2O
| ||
故答案为:2CuCl2?2H2O
| ||
点评:本题考查了金属的电化学腐蚀、酸碱混合溶液的计算、盐的水解原理的应用,题目综合性较强,侧重于考查学生对基础知识的应用能力,题目难度中等.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1.下列有关元素X的说法错误的是( )
| A、元素X不可能是金属元素 |
| B、元素X的气态氢化物不一定是电解质 |
| C、元素X一定能形成化学式为KXO3的含氧酸钾盐 |
| D、工业上制取X的单质时一定采用氧化还原反应 |
下列变化不能通过一步化学反应实现的是( )
| A、N2→NO |
| B、Cl2→FeCl2 |
| C、SiO2→H2SiO3 |
| D、S→SO2 |
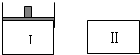 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B、若X、Y不均为气态,到达平衡后若在Ⅰ中再加入1molZ,则新平衡时Y的体积分数变大 |
| C、若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ |
| D、若X、Y不均为气态,到平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小 |
下列说法中,正确的是( )
| A、在气体反应中,增大压强能使反应物中活化分子百分数增加 |
| B、活化分子间的碰撞一定是有效碰撞 |
| C、不同化学反应需要的活化能有可能差别很大 |
| D、反应的活化能大小不会影响化学反应速率 |

 发生酯化反应的产物A是一种食用香料.11.6g甲完全燃烧可产生0.6mol CO2和0.6mol H2O.相同条件下,甲蒸气对氢气的相对密度为29,甲分子为链状结构且不含甲基.回答下列问题:
发生酯化反应的产物A是一种食用香料.11.6g甲完全燃烧可产生0.6mol CO2和0.6mol H2O.相同条件下,甲蒸气对氢气的相对密度为29,甲分子为链状结构且不含甲基.回答下列问题: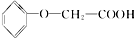 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为
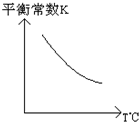 工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表: