题目内容
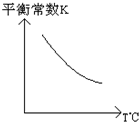 工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
(1)下列可以判断该反应达到化学平衡状态的是
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q
(3)若在850℃时向反应容器中充入H2O(g),K值
(4)达平衡时CO2的反应速率
考点:化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)A.任何时候,正反应速率之比等于化学计量数之比;
B.反应前后气体的物质的量不变,温度一定,容器中压强始终不变;
C.反应达到平衡状态时,各物质的浓度不变;
D.氢气的生成速率等于水的消耗速率,正逆反应速率相等;
(2)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断△H;
(3)平衡常数只与温度有关,由图可知升高反应体系的温度平衡常数减小;
(4)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,转化率=
×100%.
B.反应前后气体的物质的量不变,温度一定,容器中压强始终不变;
C.反应达到平衡状态时,各物质的浓度不变;
D.氢气的生成速率等于水的消耗速率,正逆反应速率相等;
(2)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断△H;
(3)平衡常数只与温度有关,由图可知升高反应体系的温度平衡常数减小;
(4)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,转化率=
| CO浓度变化量 |
| CO的起始量 |
解答:
解:(1)A.任何时候,单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度,不能说明到达平衡,故A错误;
B.反应前后气体的物质的量不变,温度一定,容器中压强始终不变,所以压强不发生变化,不能说明到达平衡,故B错误;
C.反应达到平衡状态时,各物质的浓度不变,说明到达平衡状态,故C正确;
D.任何时候,氢气的生成速率等于水的消耗速率,不能说明到达平衡状态,故D错误;
故答案为:C.
(2)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故△H<0,故答案为:<;
(3)在850℃时向反应容器中充入H2O(g),平衡正向移动,但K值不变,平衡常数随温度变化,故答案为:不变;
(4)设一氧化碳消耗浓度为a
CO+H2O(g)?CO2 +H2,
起始(mol/L) 0.200 0.300 0 0
反应(mol/L) a a a a
平衡(mol/L) 0.200-a 0.300-a a a
k=
=
=1,解得a=0.12,
所以c2=0.300-a=0.18,
达平衡时CO2的反应速率=
=0.04mol/L?min;
CO(g)的转化率为
×100%=
×100%=60%,
故答案为:0.04 mol/(L?min); 60%.
B.反应前后气体的物质的量不变,温度一定,容器中压强始终不变,所以压强不发生变化,不能说明到达平衡,故B错误;
C.反应达到平衡状态时,各物质的浓度不变,说明到达平衡状态,故C正确;
D.任何时候,氢气的生成速率等于水的消耗速率,不能说明到达平衡状态,故D错误;
故答案为:C.
(2)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故△H<0,故答案为:<;
(3)在850℃时向反应容器中充入H2O(g),平衡正向移动,但K值不变,平衡常数随温度变化,故答案为:不变;
(4)设一氧化碳消耗浓度为a
CO+H2O(g)?CO2 +H2,
起始(mol/L) 0.200 0.300 0 0
反应(mol/L) a a a a
平衡(mol/L) 0.200-a 0.300-a a a
k=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| a×a |
| (0.200-a)(0.300-a) |
所以c2=0.300-a=0.18,
达平衡时CO2的反应速率=
| 0.18mol/L-0.062mol/L |
| 3min |
CO(g)的转化率为
| CO浓度变化量 |
| CO的起始量 |
| 0.12 |
| 0.200 |
故答案为:0.04 mol/(L?min); 60%.
点评:本题考查化学平衡常数及影响因素、平衡移动、平衡状态的判断以及计算等,难度中等,注意平衡状态的判断,选择的物理量随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成钠离子和氯离子 |
| B、凡溶于水后能电离出氢离子的化合物都是酸 |
| C、固体氯化钠不导电,熔融态的氯化钠可以导电 |
| D、氯化氢溶于水能导电,液态氯化氢也能导电 |
下列关于的酶是叙述中,不正确的是( )
| A、酶是一种糖类物质 |
| B、酶是一种蛋白质 |
| C、酶是生物体内产生的催化剂 |
| D、酶受到高温或重金属盐作用时会变性 |
关于乙烷,乙烯,乙炔的叙述正确的是( )
| A、三种物质是同系物关系 |
| B、均可以燃烧 |
| C、均可以发生加成反应 |
| D、均可以使酸性KMnO4褪色 |
氢氧燃料电池已用于航天飞机.以稀硫酸溶液为电解质溶液的这种电池在使用时的电极反应如下:
负极:2H2-4e-=4H+; 正极:O2+4e-+4H+=2H2O
据此作出判断,下列说法中正确的是( )
负极:2H2-4e-=4H+; 正极:O2+4e-+4H+=2H2O
据此作出判断,下列说法中正确的是( )
| A、O2在正极发生氧化反应 |
| B、供电时的总反应为:2H2+O2=2H2O |
| C、氢氧燃料电池是把电能转化为化学能 |
| D、燃料电池的能量转化率可达100% |