题目内容
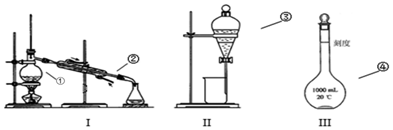
17.根据下列能量变化示意图,分析下列说法中正确的是( )
| A. | A(g)+B(g)→C(g)+D(l)是放热反应 | |
| B. | A(g)+B(g)→C(g)+D(l)是吸热反应 | |
| C. | C(g)+D(l)→A(g)+B(g)是放热反应 | |
| D. | C(g)+D(l)具有的能量大于A(g)+B(g)具有的能量 |
分析 由图可知,A(g)、B(g)的总能量大于C(g)、D(l)的总能量,则A(g)+B(g)→C(g)+D(l)放出热量,而C(g)+D(l)→A(g)+B(g)吸收热量,以此来解答.
解答 解:A.反应物总能量大于生成物总能量,则A(g)+B(g)→C(g)+D(l)是放热反应,故A正确;
B.反应物总能量大于生成物总能量,则A(g)+B(g)→C(g)+D(l)是放热反应,故B错误;
C.反应物总能量小于生成物总能量,则C(g)+D(l)→A(g)+B(g)是吸热反应,故C错误;
D.C(g)+D(l)→A(g)+B(g)是吸热反应,因C(g)+D(l)具有的能量小于A(g)+B(g)具有的能量,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、物质能量与反应能量变化的关系为解答的关键,侧重分析与应用能力的考查,注意图象的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.游泳池是公共场合,必须保持用水的清洁卫生,游泳池中的水常用漂白粉消毒,漂白粉的有效成分是( )
| A. | CaCl2 | B. | Ca(ClO)2 | C. | Ca(OH)2 | D. | HClO |
12.下列溶液中能大量共存的离子组是( )
| A. | 加入铝粉能产生H2的溶液:Fe2+、NH4+、SO42-、NO3- | |
| B. | 室温下水电离出c(H+)=1×10-13 mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 使酚酞变红色的溶液:Na+、K+、AlO2-、CO32- | |
| D. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- |
2.下列叙述正确的是( )
| A. | 若AgCl沉淀完全,就是指氯化银溶液中溶质离子的浓度为零 | |
| B. | 达到溶解平衡时,晶体就不再溶解 | |
| C. | 室温下,在100g水中能溶解1~10g的溶质,这种物质被称为可溶性物质 | |
| D. | 无机酸都是可溶的 |
9.下列变化过程中原物质分子内的共价键被破坏,同时有离子键形成的是( )
| A. | 碘升华 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 氯化氢溶于水 | D. | 氯化氢与氨气反应生成氯化铵固体 |
6.某温度下,水的电离平衡常数K电离=1.8×10-15,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合(不考虑体积变化),所得混合溶液的pH=10,则强碱与强酸的体积比约为( )
| A. | 5.6﹕1 | B. | 9﹕1 | C. | 1﹕5.6 | D. | 1﹕9 |
7.下列各个反应,不能用于工业生产的是( )
| A. | 焦炭在高温下还原二氧化硅制粗硅 | B. | 电解熔融氧化铝制金属铝 | ||
| C. | 二氧化碳和氢氧化钠反应制碳酸钠 | D. | 氯气与石灰乳反应制漂白粉 |
 .
.