题目内容
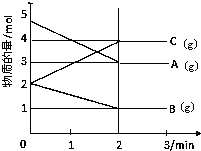 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.(1)则该反应的化学方程式为
(2)反应开始至2分钟时,能否用C表示反应速率?
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法
专题:化学平衡专题,化学反应速率专题
分析:(1)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(2)化学反应速率是单位时间内浓度的变化,据此判断;
(3)当反应达到平衡状态时,各物质的物质的量不再变化,正逆反应速率相等,反应速率之比等于计量数之比,据此判断;
(2)化学反应速率是单位时间内浓度的变化,据此判断;
(3)当反应达到平衡状态时,各物质的物质的量不再变化,正逆反应速率相等,反应速率之比等于计量数之比,据此判断;
解答:
解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,作为C为生成物,
当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,
化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,
所以反应的化学方程式为:2A+B 2C,故答案为:2A+B
2C,故答案为:2A+B 2C;
2C;
(2)由于不能确定溶液的体积,则不能计算浓度的变化,无法计算反应速率,故答案为:不能;无体积,无法求出浓度变化值;
(3)当反应达到平衡状态时,各物质的物质的量不再变化,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态,正逆反应速率相等,由于反应速率之比等于计量数之比,所以2V正(B)=V逆(C),故答案为:2V正(B)=V逆(C)
当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,
化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,
所以反应的化学方程式为:2A+B
 2C,故答案为:2A+B
2C,故答案为:2A+B 2C;
2C;(2)由于不能确定溶液的体积,则不能计算浓度的变化,无法计算反应速率,故答案为:不能;无体积,无法求出浓度变化值;
(3)当反应达到平衡状态时,各物质的物质的量不再变化,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态,正逆反应速率相等,由于反应速率之比等于计量数之比,所以2V正(B)=V逆(C),故答案为:2V正(B)=V逆(C)
点评:本题考查化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
过程的自发性的作用是( )
| A、判断过程的方向 |
| B、确定过程是否一定会发生 |
| C、判断过程发生的速率 |
| D、判断过程的热效应 |
下列叙述正确的是( )
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、 和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
决定化学反应速率的主要因素是( )
| A、反应物的浓度 |
| B、反应体系内的压强 |
| C、反应物的性质 |
| D、反应物的状态 |
s轨道与s轨道重叠形成的共价键可用符号表示为σs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号表示为σp-p,请你指出下列分子中含有σs-sp键的是( )
| A、N2 |
| B、C2H4 |
| C、C2H2 |
| D、HCl |

 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答: 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题: