题目内容
(1)常温时向水中加入少量固体MgCl2, (填“促进”或“抑制”)了水的电离;与纯水相比,所得溶液中KW (填“变大”、“变小”或“不变”).
(2)已知某溶液中只存在OH-、H+、NH
、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
A、c(Cl-)>c(NH
)>c(H+)>c(OH-) B、c(Cl-)>c(NH
)>c(OH-)>c(H+)
C、c(NH
)>c(Cl-)>c(OH-)>c(H+) D、c(Cl-)>c(H+)>c(NH
)>c(OH-)
①上述关系一定不正确的是 (填序号).
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为 (填序号).
③若四种离子浓度关系有c(NH
)=c(Cl-),则该溶液显 (填“酸性”、“碱性”或“中性”).
(3)现有下列溶液:
①20mL 0.1mol/LH2SO4溶液;
②40mL 0.1mol/L CH3COOH溶液;
③40mL 0.1mol/L HCl溶液;④40mL 0.1mol/L NaOH溶液;⑤20mL 0.1mol/L Ba(OH)2溶液,其中:
A、c(H+)最小的是 (填序号)
B、任取2份溶液混合,混合溶液的pH为7,有 种取法.
C、②④混合后,溶液的pH 7(填“大于”、“小于”或“等于”).
D、混合后出现白色沉淀的两种溶液是 .(填序号)
(4)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3溶液中的一种.已知A、B的水溶液中水的电离程度相同,A、C溶液的pH值相同.则:
①B是 溶液,C是 .
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc= (填数据).
(2)已知某溶液中只存在OH-、H+、NH
+ 4 |
A、c(Cl-)>c(NH
+ 4 |
+ 4 |
C、c(NH
+ 4 |
+ 4 |
①上述关系一定不正确的是
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为
③若四种离子浓度关系有c(NH
+ 4 |
(3)现有下列溶液:
①20mL 0.1mol/LH2SO4溶液;
②40mL 0.1mol/L CH3COOH溶液;
③40mL 0.1mol/L HCl溶液;④40mL 0.1mol/L NaOH溶液;⑤20mL 0.1mol/L Ba(OH)2溶液,其中:
A、c(H+)最小的是
B、任取2份溶液混合,混合溶液的pH为7,有
C、②④混合后,溶液的pH
D、混合后出现白色沉淀的两种溶液是
(4)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3溶液中的一种.已知A、B的水溶液中水的电离程度相同,A、C溶液的pH值相同.则:
①B是
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=
考点:离子积常数,弱电解质在水溶液中的电离平衡,盐类水解的应用,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)能水解的盐促进水的电离,水的离子积常数只收温度影响;
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,可能为氯化铵溶液或氯化铵、氨水或氯化铵、盐酸混合物.
①任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等;
②任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
③根据电荷守恒判断溶液的酸碱性.
(3)A、碱性越强,氢氧根离子浓度越大的溶液中,氢离子浓度越小;
B、当溶液中c(OH-)、c(H+)相等时,溶液pH=7;
C、醋酸钠溶液醋酸根离子会水解,导致溶液显示碱性;
D、硫酸和氢氧化钡反应生成硫酸钡白色沉淀;
(4)①A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,以此解答该题;
②根据pH=-lgc(H+)来计算回答.
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,可能为氯化铵溶液或氯化铵、氨水或氯化铵、盐酸混合物.
①任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等;
②任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
③根据电荷守恒判断溶液的酸碱性.
(3)A、碱性越强,氢氧根离子浓度越大的溶液中,氢离子浓度越小;
B、当溶液中c(OH-)、c(H+)相等时,溶液pH=7;
C、醋酸钠溶液醋酸根离子会水解,导致溶液显示碱性;
D、硫酸和氢氧化钡反应生成硫酸钡白色沉淀;
(4)①A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,以此解答该题;
②根据pH=-lgc(H+)来计算回答.
解答:
解:(1)氯化镁中镁离子水解会踧踖水的电离,水的离子积常数只收温度影响,温度不变,Kw不变,故答案为:促进;不变;
(2)①任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等,这几个选项中只有B中阴离子电荷之和大于阳离子电荷之和,与水溶液呈电中性相违背,故B一定不正确,故选B;
②因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合,
故答案为:A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒知c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(H+)=c(OH-),所以溶液呈中性,故答案为:中性.
(3)A、⑤中碱性最强,氢氧根离子浓度最大的溶液中,氢离子浓度最小,故答案为:⑤;
B、当溶液中c(OH-)=c(H+),溶液pH=7,这样的组合有:①⑤;③④;①④;③⑤四种,故答案为:4;
C、②④混合后,反应所得溶液是醋酸钠,醋酸根离子会水解,导致溶液显示碱性,即溶液的pH大于7,故答案为:大于;
D、硫酸和氢氧化钡反应生成硫酸钡白色沉淀,故答案为:①⑤;
(4)①解:CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3四种溶液,CH3COONa为强碱弱酸盐,水解成碱性,促进水的电离,NH4Cl溶液为强酸弱碱盐,水解成酸性,促进水的电离,盐酸溶液呈酸性,抑制水的电离,NaNO3为强酸强碱盐,溶液呈中性,A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,
故答案为:CH3COONa;盐酸;
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=-lg
-lg10-pHc =-lg10-14=14,故答案为:14.
(2)①任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等,这几个选项中只有B中阴离子电荷之和大于阳离子电荷之和,与水溶液呈电中性相违背,故B一定不正确,故选B;
②因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合,
故答案为:A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒知c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(H+)=c(OH-),所以溶液呈中性,故答案为:中性.
(3)A、⑤中碱性最强,氢氧根离子浓度最大的溶液中,氢离子浓度最小,故答案为:⑤;
B、当溶液中c(OH-)=c(H+),溶液pH=7,这样的组合有:①⑤;③④;①④;③⑤四种,故答案为:4;
C、②④混合后,反应所得溶液是醋酸钠,醋酸根离子会水解,导致溶液显示碱性,即溶液的pH大于7,故答案为:大于;
D、硫酸和氢氧化钡反应生成硫酸钡白色沉淀,故答案为:①⑤;
(4)①解:CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3四种溶液,CH3COONa为强碱弱酸盐,水解成碱性,促进水的电离,NH4Cl溶液为强酸弱碱盐,水解成酸性,促进水的电离,盐酸溶液呈酸性,抑制水的电离,NaNO3为强酸强碱盐,溶液呈中性,A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,
故答案为:CH3COONa;盐酸;
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=-lg
| 10-14 |
| 10-pHb |
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒来分析解答,题目难度中等.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
下列物质中,含有离子键的是( )
| A、烧碱 | B、双氧水 | C、硫酸 | D、氨气 |
结构简式为 的物质.下列叙述错误的是( )
的物质.下列叙述错误的是( )
 的物质.下列叙述错误的是( )
的物质.下列叙述错误的是( )| A、能与Br2/CCl4溶液发生加成反应 |
| B、能与银氨溶液发生氧化(银镜)反应 |
| C、能与NaOH溶液发生中和反应 |
| D、能与冰醋酸发生酯化反应 |
下列反应中,属于放热反应的是( )
①NaOH溶液中加入盐酸 ②C与CO2反应生成CO ③铝热反应 ④由氯酸钾制O2.
①NaOH溶液中加入盐酸 ②C与CO2反应生成CO ③铝热反应 ④由氯酸钾制O2.
| A、①② | B、②③ | C、①③ | D、①④ |
C(s)+H2O(g)
CO(g)+H2(g)是吸热反应,则CO(g)+H2(g)═C(s)+H2O(g)是( )
| ||
| A、放热反应,也是氧化还原反应 |
| B、吸热反应,也是置换反应 |
| C、既不是放热反应,也不是吸热反应 |
| D、无法判断是吸热反应还是放热反应 |


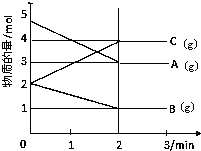 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.