题目内容
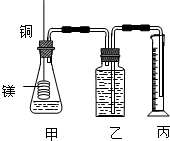 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:a.配制浓度均为1mol?L-1盐酸和醋酸溶液;
b.用
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应
请将上述步骤补充完整并回答下列问题:
(1)用文字表述d检查该装置气密性的操作与观察方法:
(2)本实验中应选用
A.100mL B.200mL C.500mL
(3)简述速率不等的原因
考点:性质实验方案的设计,探究影响化学反应速率的因素
专题:实验设计题
分析:b.根据酸式滴定管和碱式滴定管的使用要求以及精确度来选择;
c.根据化学方程式进行计算;
e.比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
f.读数时要保持左右气体压强相等,以减少误差;
(1)从检查装置的气密性的原理来考虑;
(2)根据反应的化学方程式计算生成标况下氢气的体积,然后判断量筒规格;
(3)从影响化学反应速率的因素来分析;根据镁与铜易形成原电池,加快反应速率,干扰实验测定.
c.根据化学方程式进行计算;
e.比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
f.读数时要保持左右气体压强相等,以减少误差;
(1)从检查装置的气密性的原理来考虑;
(2)根据反应的化学方程式计算生成标况下氢气的体积,然后判断量筒规格;
(3)从影响化学反应速率的因素来分析;根据镁与铜易形成原电池,加快反应速率,干扰实验测定.
解答:
解:b.题中要求酸的体积10.00 mL较精确,应选酸式滴定管,如用碱式滴定管会腐蚀橡胶管,
故答案为:酸式滴定管;
c.Mg+2HCl(或HAc)═MgCl2+H2↑
24g 2 mol
a 1mol/L×0.01L
a=0.12 g.
故答案为:0.12;
e.比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应所需时间;
f.读数时要保持左右气体压强相等,以减少误差,操作方法为:将量筒缓缓向下移动,使乙、丙中液面相平,
故答案为:将量筒缓缓向下移动,使乙、丙中液面相平;
(1)如不漏气,加热时容器内压强增大,会有气泡冒出,所以检查该装置气密性的操作与观察方法为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气,
故答案为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
(2)Mg+2HCl(或HAc)═MgCl2+H2↑
2 mol 1 mol
1 mol/L×0.01 L n(H2)
n(H2)=0.005 mol,V(H2)=0.005 mol×22.4L/mol=0.112L=112ml,应选200 mL量筒,
故答案为:B;
(3)影响化学反应速率的因素有浓度、温度、压强等,本题为H+浓度不同;镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:酸的浓度相同时c(H+)不同;防止形成原电池,干扰实验现象的观察.
故答案为:酸式滴定管;
c.Mg+2HCl(或HAc)═MgCl2+H2↑
24g 2 mol
a 1mol/L×0.01L
a=0.12 g.
故答案为:0.12;
e.比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应所需时间;
f.读数时要保持左右气体压强相等,以减少误差,操作方法为:将量筒缓缓向下移动,使乙、丙中液面相平,
故答案为:将量筒缓缓向下移动,使乙、丙中液面相平;
(1)如不漏气,加热时容器内压强增大,会有气泡冒出,所以检查该装置气密性的操作与观察方法为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气,
故答案为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
(2)Mg+2HCl(或HAc)═MgCl2+H2↑
2 mol 1 mol
1 mol/L×0.01 L n(H2)
n(H2)=0.005 mol,V(H2)=0.005 mol×22.4L/mol=0.112L=112ml,应选200 mL量筒,
故答案为:B;
(3)影响化学反应速率的因素有浓度、温度、压强等,本题为H+浓度不同;镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:酸的浓度相同时c(H+)不同;防止形成原电池,干扰实验现象的观察.
点评:本题考查了物质性质实验方案的设计、探究影响反应速率的因素等知识,题目难度中等,注意掌握化学实验基本操作方法、影响化学反应速率的因素,明确物质性质实验方案的设计方法,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、金刚石和石墨互为同素异形体 | ||||
| B、1H、2H和3H互为同位素 | ||||
| C、18O和16O是两种不同的核素 | ||||
D、氡的放射性同位素
|
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是( )
| A、H2C2O4在反应中被还原 |
| B、ClO2是氧化产物 |
| C、KClO3 在反应中得到电子 |
| D、1 mol KClO3 参加反应有 2 mol 电子转移 |
下列实验方案设计中,可行的是( )
| A、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 |
| B、用萃取的方法分离汽油和煤油 |
| C、用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
