题目内容
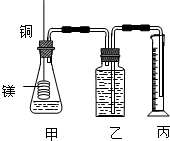
某学生设计了以下实验方案,验证铜和一定量(10mL)浓HNO3反应过程中会产生NO气体,实验装置如下图所示(装置的气密性良好),请回答下列问题:

(1)在反应前通入N2的作用是 ,进行这步操作时应打开K3和 (填K1、K2.下同),而关闭 .
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,此步骤的目的是 .
(3)B中发生的反应化学方程式 .用C装置读排出水的体积时,应注意 .
(4)若实验结束后,测得B容器中所得溶液体积是100mL,溶质物质的量浓度是0.08mol/L,C装置中气体的体积为120.0mL(已折算成标准状况),那么上述反应过程是否有NO生成 (填“有”或“无”),判断的依据是 .

(1)在反应前通入N2的作用是
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,此步骤的目的是
(3)B中发生的反应化学方程式
(4)若实验结束后,测得B容器中所得溶液体积是100mL,溶质物质的量浓度是0.08mol/L,C装置中气体的体积为120.0mL(已折算成标准状况),那么上述反应过程是否有NO生成
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据NO的性质分析;由装置图可知N2从K3进,空气从K1排出;
(2)根据实验目的生成的NO2尽量与B瓶中的水反应,所以分液漏斗向试管中加40mL蒸馏水排出试管中二氧化氮;
(3)B中发生的反应是二氧化氮与水反应,读数时要保持左右气体压强相等,以减少误差;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,已知试管的容积为50ml,所以原来试管内液体为10ml,则试管内的氮气为40ml;C装置测得所收集到的气体体积不等于二氧化氮产生的NO与氮气的体积和.
(2)根据实验目的生成的NO2尽量与B瓶中的水反应,所以分液漏斗向试管中加40mL蒸馏水排出试管中二氧化氮;
(3)B中发生的反应是二氧化氮与水反应,读数时要保持左右气体压强相等,以减少误差;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,已知试管的容积为50ml,所以原来试管内液体为10ml,则试管内的氮气为40ml;C装置测得所收集到的气体体积不等于二氧化氮产生的NO与氮气的体积和.
解答:
解:(1)NO易被空气中的氧气氧化,所以要先用氮气排净装置中的空气;由装置图可知N2从K3进,空气从K1排出,所以要关闭 K2,打开K1、K3;
故答案为:排除装置中的空气,防止生成的NO被氧化;K2;K1、K3;
(2)实验目的生成的NO2尽量与B瓶中的水反应,所以分液漏斗向试管中加40mL蒸馏水排出试管中二氧化氮;故答案为:使生成的NO2尽量与B瓶中的水反应;
(3)B中发生的反应是二氧化氮与水反应,方程式为:3NO2+H2O═2HNO3+NO,读数时要保持左右气体压强相等,以减少误差,即保持两边液面相平,还要用眼睛平视读数;故答案为:3NO2+H2O═2HNO3+NO;保持两边液面相平,眼睛平视读数;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,则试管内的氮气为40ml;C装置测得所收集到的气体体积120mL,二氧化氮与水反应产生的NO为0.08mol/L×0.1L×
×22.4×103ml=59.7ml,氮气的体积为40ml,59.7ml+40ml<120.0mL,说明原来气体中有NO;
故答案为:有;若只由NO2和水产生NO,则C装置中气体的总体积不等于120mL.
故答案为:排除装置中的空气,防止生成的NO被氧化;K2;K1、K3;
(2)实验目的生成的NO2尽量与B瓶中的水反应,所以分液漏斗向试管中加40mL蒸馏水排出试管中二氧化氮;故答案为:使生成的NO2尽量与B瓶中的水反应;
(3)B中发生的反应是二氧化氮与水反应,方程式为:3NO2+H2O═2HNO3+NO,读数时要保持左右气体压强相等,以减少误差,即保持两边液面相平,还要用眼睛平视读数;故答案为:3NO2+H2O═2HNO3+NO;保持两边液面相平,眼睛平视读数;
(4)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,则试管内的氮气为40ml;C装置测得所收集到的气体体积120mL,二氧化氮与水反应产生的NO为0.08mol/L×0.1L×
| 1 |
| 3 |
故答案为:有;若只由NO2和水产生NO,则C装置中气体的总体积不等于120mL.
点评:本题考查了物质性质的分析应用,实验设计的判断,物质反应的计算应用,主要考查及其化合物性质的分析应用,题目难度中等.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质.若将CO2与H2混合,在一定条件下以体积比为1:3发生反应,可生成某种重要的化工原料和水.该化工原料可能是( )
| A、烷烃 | B、烯烃 | C、炔烃 | D、芳香烃 |
科学的假设与猜想是科学探究的先导和价值所在.在下列假设或猜想引导下的探究肯定没有意义的是( )
| A、探究SO2和Na2O2反应可能有Na2SO4生成 |
| B、探究NO和N2O可能化合生成NO2 |
| C、探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O |
| D、探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用 |
在一容积固定的密闭容器中进行反应:2SO2(g)+O2(g)??2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1.当反应达到平衡时,各物质的浓度可能存在的数据是( )
| A、SO2为0.4 mol?L-1,O2为0.2 mol?L-1 |
| B、SO2为0.25 mol?L-1 |
| C、SO2和SO3均为0.15 mol?L-1 |
| D、SO2为0.4 mol?L-1 |
浓度均为0.1mol.L-1的Na2CO3和盐酸各0.5L,有甲乙两位同学进行实验,甲向Na2CO3溶液中滴加盐酸至完全反应乙向盐酸中滴加Na2CO3至完全反应.两位同学在实验过程中产生的CO2气体比较结果正确的是( )
| A、甲>乙 | B、甲<乙 |
| C、甲=乙 | D、无法确定 |
常温常压下能大量共存,并可用浓硫酸干燥的一组气体是( )
| A、SO2、H2S、Cl2 |
| B、O2、CO2、NO |
| C、O2、H2、SO2 |
| D、NH3、N2、HCl |
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下: