题目内容
将6molX和3molY混合气体置于体积可变的等压容器中,在一定温度下发生反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体的总物质的量为6.6mol.若起始时X为3.2mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时Y应为多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:达到平衡后各气体的体积分数与平衡状态A相同,则此时建立的平衡和原来的平衡是等效的,根据三行式计算即可.
解答:
解:2X(g)+Y(g)?2Z(g)
初始量:6mol 3mol 0
变化量:2x x 2x
平衡量:6-2x 3-x 2x
达到平衡状态A时,气体的总物质的量为6.6mol,即6-2x+3-x+2x=6.6,解得x=2.4mol,
达到平衡后各气体的体积分数与平衡状态A相同,则此时建立的平衡和原来的平衡是等效的,
设起始时Y的物质的量是y,混合气体置于体积可变的等压容器中,等比即等效,则达到平衡时,X、Y、Z的平衡量分别是1.2mol、0.6mol、4.8mol,若起始时X为3.2mol,达到平衡时的物质的量是1.2mol,所以X的变化量是2.0mol,变化量之比等于系数之比,所以变化的Y是1.0mol,即
2X(g)+Y(g)?2Z(g)
初始量:3.2mol y
变化量:2.0mol 1.0mol
平衡量:1.2mol 0.6mol 4.8mol
则
=
,解得y=1.6mol,
答:起始时Y的物质的量是1.6mol.
初始量:6mol 3mol 0
变化量:2x x 2x
平衡量:6-2x 3-x 2x
达到平衡状态A时,气体的总物质的量为6.6mol,即6-2x+3-x+2x=6.6,解得x=2.4mol,
达到平衡后各气体的体积分数与平衡状态A相同,则此时建立的平衡和原来的平衡是等效的,
设起始时Y的物质的量是y,混合气体置于体积可变的等压容器中,等比即等效,则达到平衡时,X、Y、Z的平衡量分别是1.2mol、0.6mol、4.8mol,若起始时X为3.2mol,达到平衡时的物质的量是1.2mol,所以X的变化量是2.0mol,变化量之比等于系数之比,所以变化的Y是1.0mol,即
2X(g)+Y(g)?2Z(g)
初始量:3.2mol y
变化量:2.0mol 1.0mol
平衡量:1.2mol 0.6mol 4.8mol
则
| 3.2 |
| y |
| 1.2 |
| 0.6 |
答:起始时Y的物质的量是1.6mol.
点评:本题考查学生化学平衡的计算和等效平衡的建立方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
下列关于
Ne和
Ne的说法正确的是( )
| ||
| 10 |
| ||
| 10 |
| A、质子数相等 | B、质量数相等 |
| C、中子数相等 | D、性质相同 |
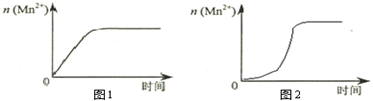
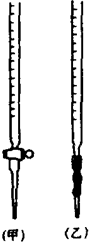 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答: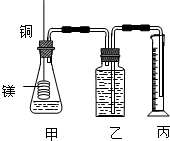 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下: