题目内容
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图甲所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图乙所示.试回答:0~10min内,氢气的平均反应速率为 mol/(L?min);该温度下,反应的平衡常数的值为 ;第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数 (填变大、减少、不变).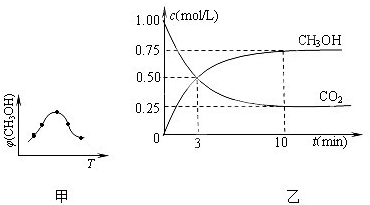
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图甲所示,则上述CO2转化为甲醇的反应的△H3
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图乙所示.试回答:0~10min内,氢气的平均反应速率为

考点:热化学方程式,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到.
(2)①先根据图表,利用v=
计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);
该温度下该反应的K=
;利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算平衡常数;
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大;
②到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
(3)配制100ml一定物质的量浓度的硫酸铵溶液所需玻璃仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管.
(2)①先根据图表,利用v=
| △c |
| △t |
该温度下该反应的K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大;
②到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
(3)配制100ml一定物质的量浓度的硫酸铵溶液所需玻璃仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管.
解答:
解:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
两式相加可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0.
故答案为:<
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
=0.075mol/(L?min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225mol/(L?min);
开始CO2的浓度为1mol/L,故容器的体积为
=1L,H2的起始浓度为
=3mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故该温度下平衡常数k=
=5.33;
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大,
故答案为:0.225mol/(L?min);5.33;变大;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
两式相加可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0.
故答案为:<
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
| 0.75mol/L |
| 10min |
开始CO2的浓度为1mol/L,故容器的体积为
| 1mol |
| 1mol/L |
| 3mol |
| 1L |
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故该温度下平衡常数k=
| 0.75×0.75 |
| 0.25×0.753 |
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大,
故答案为:0.225mol/(L?min);5.33;变大;
点评:本题以燃煤废气进行脱碳和脱硫等处理为载体,考查化学平衡有关图象、反应速率计算、平衡常数计算、影响化学平衡的因素等,难度中等,培养了学生分析问题解决问题的能力.

练习册系列答案
相关题目
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素的说法正确的是( )
| A、在自然界中既有化合态又有游离态 |
| B、单质常用作半导体材料 |
| C、气态氢化物很稳定 |
| D、最高价氧化物不与任何酸反应,可制光导纤维 |
下列离子方程式正确的是(??)
| A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H20 |
| B、碳酸钠溶液与盐酸反应 Na2CO3+2H+?=2Na++H2O+CO2↑ |
| C、稀硫酸与氢氧化钡溶液反应 H++OH-+Ba2++SO42-=H2O+BaSO4↓ |
| D、氢氧化铜与稀硫酸反应 Cu(OH)2+2H+=Cu2++2H2O |
下列实验中没有颜色变化的是( )
| A、蔗糖溶液中加入稀硫酸 |
| B、鸡蛋清中加入浓硝酸 |
| C、淀粉溶液中加入碘酒 |
| D、麦芽糖溶液与新制的Cu(OH)2浊液混合加热 |
在下列各溶液中,离子一定能大量共存的是( )
| A、室温下,pH=13的溶液中:K+、Al3+、Cl-、SO42- |
| B、含有1mol?L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、由水电离的c(H+)=10-12 mol?L-1的溶液中,K+、Na+、Cl-、SO4 |
| D、室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
下列叙述正确的是( )
| A、摩尔质量的单位是:g/mol |
| B、石英的化学式为:CaSiO3 |
| C、乙烯的结构简式为:C2H4 |
| D、氢氧化钠的电离方程式为:NaOH═Na++O2-+H+ |
在水溶液中能大量共存的离子组是( )
| A、K+、Al3+、SO42-、OH- |
| B、Ca2+、Na+、Cl-、NO3- |
| C、Na+、NH4+、NO3-、OH- |
| D、Na+、H+、CO32-、Cl- |