题目内容
19.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.
方法Ⅰ:次氯酸盐氧化法.
工艺流程如图所示.
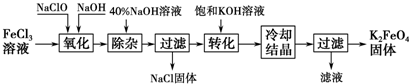
(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O.
(2)“转化”过程中发生反应的化学方程式为Na2FeO4+2KOH═K2FeO4+2NaOH.
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为重结晶法.
方法Ⅱ:电解法.
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O.
分析 FeCl3溶液、NaClO溶液和NaOH溶液混合发生氧化还原反应,反应方程式为FeCl3+2NaOH+10NaClO=2Na2FeO4+9NaCl+5H2O,加入40%的NaOH溶液除杂,过滤得到NaCl固体和滤液,滤液中加入KOH溶液实现Na2FeO4转化为K2FeO4,然后蒸发浓缩、冷却结晶、过滤得到K2FeO4固体,上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯;
(1)FeCl3溶液、NaClO溶液和NaOH溶液混合发生氧化还原反应生成高铁酸钠、氯化钠和水;
(2)高铁酸钠和KOH反应生成高铁酸钾和NaOH;
(3)高铁酸钾常含有杂质,可用重结晶法提纯;
(4)Fe作阳极电解NaOH溶液,阳极上Fe失电子和OH-反应生成FeO42-和水,阴极上氢离子放电生成氢气.
解答 解:(1)FeCl3溶液、NaClO溶液和NaOH溶液混合发生氧化还原反应生成高铁酸钠、氯化钠和水,反应方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,
故答案为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
(2)高铁酸钠和KOH反应生成高铁酸钾和NaOH,反应方程式为Na2FeO4+2KOH═K2FeO4+2NaOH,故答案为:Na2FeO4+2KOH═K2FeO4+2NaOH;
(3)工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为重结晶,故答案为:重结晶;
(4)Fe作阳极电解NaOH溶液,阳极上Fe失电子和OH-反应生成FeO42-和水,阴极上氢离子放电生成氢气,阳极反应式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题以氧化还原反应、电解法为载体考查物质制备,为高频考点,涉及物质分离提纯方法、电极反应式的书写、氧化还原反应等知识点,侧重于学生的分析能力、判断及知识综合运用能力的考查,注意(4)中如果活泼电极作阳极时,阳极上电极失电子发生氧化反应,为易错点.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案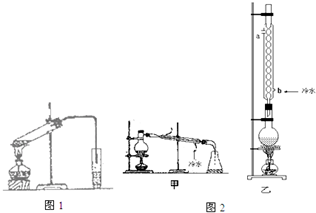 已知如表数据:
已知如表数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,写出原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为乙装置合理,因为反应物能冷凝回流.
| 实验 序号 | 浓度 mol•L-1 温度(℃)时间( min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
(1)实验1中,10~20min内A的反应速率为0.013mol•L-1•min-1.
(2)实验2中,c2=1.0,反应经20min时达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设10~20min内实验3中A的反应速率为v3,实验1中A的反应速率为v1,则v3>(填“>”、“=”或“<”)v1,且c3>(填“>”、“=”或“<”)1.0.
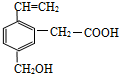 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H3=74.8kJ•mol-1 |
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:
取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-).注:相对原子质量Cl35.5,Na23,S32,O 16,I 127,K39
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟不恢复.
②此消毒液有效氯含量为1.42%(保留一位有效数字).
获得结论:此实验制得的消毒液不符合(填“符合”或“不符合”)家用要求.
S(s,单斜)+O2(g)=SO2(g)+297.16kJ;
S(s,正交)+O2(g)=SO2(g)+296.83kJ
下列说法正确的是( )
| A. | S(g)+O2(g)=SO2(g)+Q3 Q3>297.16 kJ | |
| B. | 单斜硫和正交硫互为同分异构体 | |
| C. | 常温下单斜硫比正交硫稳定 | |
| D. | 单斜硫转化为正交硫的反应是吸热反应 |
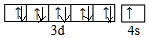 .
.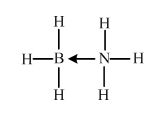 (必须标明配位键).
(必须标明配位键).