题目内容
7.某化学反应2A?B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如表.| 实验 序号 | 浓度 mol•L-1 温度(℃)时间( min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
(1)实验1中,10~20min内A的反应速率为0.013mol•L-1•min-1.
(2)实验2中,c2=1.0,反应经20min时达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设10~20min内实验3中A的反应速率为v3,实验1中A的反应速率为v1,则v3>(填“>”、“=”或“<”)v1,且c3>(填“>”、“=”或“<”)1.0.
分析 (1)结合v=$\frac{△c}{△t}$计算;
(2)实验1、2中,平衡浓度相同,则开始浓度相同,但实验2中反应速率大;
(3)实验3中平衡浓度大,则开始浓度大,10~20min内,实验1中A浓度减少0.80-0.67=0.13mol/L,实验3中A的浓度减少0.92-0.75=0.17mol/L.
解答 解:(1)实验1中,10~20min内A的反应速率为$\frac{0.8mol/L-0.67mol/L}{10min}$=0.013mol•L-1•min-1,故答案为:0.013;
(2)实验1、2中,平衡浓度相同,则开始浓度相同,则c2=1.0,但实验2中反应速率大,可推测实验2中还隐含的条件是使用了催化剂,
故答案为:1.0;使用了催化剂;
(3)实验1中A浓度减少0.80-0.67=0.13mol/L,实验3中A的浓度减少0.92-0.75=0.17mol/L,则实验3中反应速率快,即v3>v1,实验3中平衡浓度大,则开始浓度大,则c3>1.0,故答案为:>;>.
点评 本题考查化学反应速率的影响因素及实验探究,为高频考点,把握控制变量法、平衡浓度与起始浓度的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
18.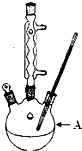 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
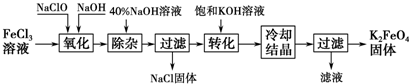
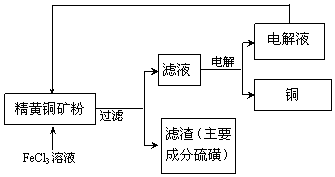
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
请回答:
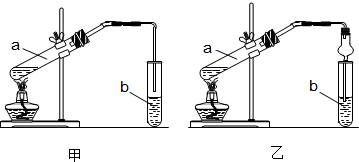
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
2.科学家正在研究温室气体CH4和CO2的转化和利用.
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为H<C<O.
(2)下列关于CH4和CO2的说法正确的是ad(填序号).
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为[Ar]3d84s2,该元素位于元素周期表中的第VIII族.
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有8mol σ键.
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”.

①“可燃冰”中分子间存在的2种作用力是氢键,范德华力.
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷.
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为H<C<O.
(2)下列关于CH4和CO2的说法正确的是ad(填序号).
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为[Ar]3d84s2,该元素位于元素周期表中的第VIII族.
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有8mol σ键.
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”.

 | 分子直径/nm | 分子与H2O的结合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷.
12.四种有机物A、B、C、D分子式均为C3H6O2,把它们分别进行实验并记录现象如下:
四种物质的结构简式为:
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
16.已知:2H2(g)+O2(g)=2H2O(g),1molH2完全燃烧放出热量241.8KJ,有关键能数据如下:
则H-H键键能为( )
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 557KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
 H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是 B.
B.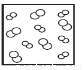 C.
C.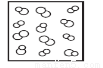 D.
D.