题目内容
2.按要求写出下列物质的结构简式:(1)2,4二氯甲苯的结构简式为
 ;
;(2)反-2-戊烯的结构简式为
 ;
;(3)分子式为C6H12的某烯烃与氢气加成后得到的烷烃分子中含4个甲基,且该烯烃不存在顺反异构体,则该烯烃的结构简式为(CH3)2CH=CH(CH3)2.
分析 (1)甲基连接的碳为1号C,在2、4号C各含有一个氯原子;
(2)反式为在碳碳双键的异侧,据此解答即可;
(3)与氢气加成后得到的烷烃分子中含4个甲基,且该烯烃不存在顺反异构体,碳链骨架不变.
解答 解:(1)2,4-二氯甲苯的主链为甲苯,甲苯所在的C为1号C,在2、4号C各含有一个氯原子,该有机物结构简式为 ,
,
故答案为: ;
;
(2)反-2-戊烯:2-戊烯的反式结构中H原子或不同基团不在C=C的同一侧,反-2-戊烯的结构简式为:
故答案为:
(3)与氢气加成后得到的烷烃分子中含4个甲基,且该烯烃不存在顺反异构体,碳链骨架不变,则该烯烃为(CH3)2CH=CH(CH3)2,
故答案为:(CH3)2CH=CH(CH3)2.
点评 本题考查结构与性质,注意把握官能团与性质的关系,明确烯烃的性质及同分异构体即可解答,注重知识的迁移应用,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
12.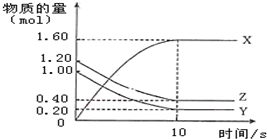 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
13.检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( )
| A. | 稀硝酸 | B. | KSCN溶液 | C. | 溴水 | D. | 酸性KMnO4溶液 |
10.下列叙述正确的是( )
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
17.下列有机物命名正确的是( )
| A. |  1,3,4-三甲基苯 | B. |  2-甲基氯丙烷 | C. |  2-丁醇 | D. |  2-甲基-3-丁炔 |
7.铝热反应原理可以应用在生产上,例如焊接钢轨、冶炼难熔金属、制作传统的烟火剂等.某小组同学在研究铝热反应时,进行如下讨论和实验.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是
NaOH溶液,写出该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是
NaOH溶液,写出该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
14.某反应过程如图所示,关于该反应的下列说法中不正确的是( )


| A. | 该反应可能为可逆反应 | |
| B. | 该反应可表示为2AB2?2AB3 | |
| C. | 单位时间内生成1 mol B2的同时生成2 mol AB2,这表明该反应已达平衡 | |
| D. | 该过程中,已反应的AB2占AB2总数的$\frac{2}{3}$ |
12.下列措施或叙述不合理的是( )
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | SO2具有强还原性,浓硫酸具有强氧化性,故浓硫酸不能用于干燥SO2气体 | |
| C. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 | |
| D. | Na2SO3与H2O2的反应为氧化还原反应 |