题目内容
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,1 mol甲基(-CH3)所含的电子数为9NA |
| B、9 g重水所含有的电子数为5NA |
| C、标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA |
| D、1molCl2参加反应,转移电子数一定为2NA个 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.甲基中含有9个电子,1mol甲基中含有9mol电子;
B.重水的摩尔质量为20g/mol,重水中含有10个电子,9g重水的物质的量为0.45mol,含有4.5mol电子;
C.标准状况下,氯仿的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子.
B.重水的摩尔质量为20g/mol,重水中含有10个电子,9g重水的物质的量为0.45mol,含有4.5mol电子;
C.标准状况下,氯仿的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子.
解答:
解:A.1mol甲基中含有9mol电子,所含的电子数为9NA,故A正确;
B.9g重水的物质的量为0.45mol,0.45mol重水中含有4.5mol电子,含有的电子数目为4.5NA,故B错误;
C.标况下氯仿不是气体,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量,故C错误;
D.氯气与氢氧化钠溶液的反应中,1mol氯气完全反应转移了1mol电子,转移电子数一定为NA个,故D错误;
故选A.
B.9g重水的物质的量为0.45mol,0.45mol重水中含有4.5mol电子,含有的电子数目为4.5NA,故B错误;
C.标况下氯仿不是气体,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量,故C错误;
D.氯气与氢氧化钠溶液的反应中,1mol氯气完全反应转移了1mol电子,转移电子数一定为NA个,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项D为易错点,注意氯气与水、氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂.

练习册系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )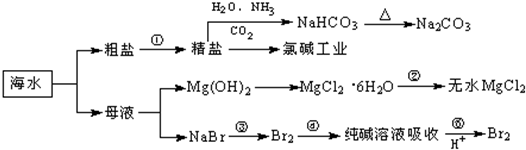

| A、由精盐制备NaHCO3的反应本质上属于复分解反应 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、氯碱工业是通过电解饱和食盐水得到烧碱、氯气和氢气;工业上制取金属镁是通过电解饱和MgCl2溶液 |
| D、在第④步反应中Br2既是氧化剂又是还原剂,在第⑤步反应中Br2既是氧化产物又是还原产物 |
下列化合物中,能够发生酯化、加成和氧化3种反应的是:①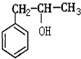 ; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )
; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )
 ; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )
; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )| A、①③⑤ | B、②④⑤ |
| C、①③④ | D、②③⑤ |
在水中加入少量硫酸氢钠后,则溶液的 ( )
| A、pH增大 |
| B、c(OH-)增大 |
| C、水电离出的c(H+)增加了 |
| D、c(H+)与c(OH-)的乘积不变 |
从物质的量浓度为1mol?L-1的氢氧化钠溶液1L中取出100mL.下面关于这100mL溶液的叙述中不正确的是( )
| A、物质的量浓度为0.1mol?L-1 |
| B、物质的量浓度为1mol?L-1 |
| C、含氢氧化钠4g |
| D、含氢氧化钠0.1mol |
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1催化剂450℃、1MPa |
| B、450℃、1MPa下,将1mol SO2和0.5molO2置于密闭的容器中充分反应生成SO3(g),放热98.5kJ,其热化学方程式为:2SO2+O2(g)?2 SO3(g)△H=-98.5kJ?mol-1 |
| C、氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D、用FeCl3溶液腐蚀铜箔:Cu+2Fe3+═2Fe2++Cu2+ |
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).