题目内容
硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂.
请回答:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性.用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性.
(2)工业上用洗净的废铜屑作原料来制备硝酸铜.下列制备方法符合“绿色化学”思想的是 (填序号).写出②的离子方程式: .
①Cu+HNO3(浓)?Cu(NO3)2
②Cu+HNO3(稀)?Cu(NO3)2
③Cu CuO?Cu(NO3)2.
请回答:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有
(2)工业上用洗净的废铜屑作原料来制备硝酸铜.下列制备方法符合“绿色化学”思想的是
①Cu+HNO3(浓)?Cu(NO3)2
②Cu+HNO3(稀)?Cu(NO3)2
③Cu CuO?Cu(NO3)2.
考点:硝酸的化学性质,浓硫酸的性质
专题:元素及其化合物
分析:(1)浓硫酸具有强氧化性,常温下能使铁、铝发生钝化现象;浓硫酸具有脱水性,能将木材中的氢原子和氧原子按2:1比例脱去;
(2)“绿色化学”思想指的是化学反应中没有污染性的物质生成、原子利用率高的反应;铜与稀硝酸反应生成硝酸铜、一氧化氮和水.
(2)“绿色化学”思想指的是化学反应中没有污染性的物质生成、原子利用率高的反应;铜与稀硝酸反应生成硝酸铜、一氧化氮和水.
解答:
解:(1)浓硫酸是氧化性酸,常温下,会使铁、铝发生钝化,即在铁、铝的表面形成一层致密的氧化物,从而阻止了酸与金属的接触,而使反应终止,因此可以在常温下用铁制容器、铝制容器来盛装浓硫酸;用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,是浓硫酸脱水性的表现,
故答案为:氧化;脱水;
(2)“绿色化学”思想指的是化学反应中没有污染性的物质生成、原子利用率高的反应,在反应①中Cu与浓硝酸反应生成硝酸铜,同时生成NO2,污染环境,②中Cu与稀硝酸反应生成硝酸铜,同时生成NO,污染环境,只有制备方法③铜与氧气反应生成CuO,与硝酸反应消耗硝酸最少,且没有生成污染性气体,符合“绿色化学”思想;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为3Cu+8H++2NO3-═3Cu2+++2NO↑+4H2O,
故答案为:③;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:氧化;脱水;
(2)“绿色化学”思想指的是化学反应中没有污染性的物质生成、原子利用率高的反应,在反应①中Cu与浓硝酸反应生成硝酸铜,同时生成NO2,污染环境,②中Cu与稀硝酸反应生成硝酸铜,同时生成NO,污染环境,只有制备方法③铜与氧气反应生成CuO,与硝酸反应消耗硝酸最少,且没有生成污染性气体,符合“绿色化学”思想;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为3Cu+8H++2NO3-═3Cu2+++2NO↑+4H2O,
故答案为:③;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评:本题考查浓硫酸以及硝酸的化学性质,属于元素以及化合物知识的考查,题目难度不大,注意考查硝酸铜制备的方案评价,利用产物对环境的污染角度是解答关键.

练习册系列答案
相关题目
关于由锌片、铜片和稀硫酸组成的原电池的说法中,正确的是( )
| A、锌片作负极,发生还原反应 |
| B、电流方向是由锌片流向铜片 |
| C、锌片质量逐渐减少,铜片上有气泡产生 |
| D、电解质溶液的氢离子浓度保持不变 |
能正确表示下列反应的离子方程式的是( )
| A、氢氧化钡溶液与硫酸反应:H++OH-=H2O |
| B、铁溶于氯化铁溶液:Fe3++Fe=2Fe2+ |
| C、氢氧化钠溶液与硫酸铜溶液反应:2OH-+Cu2+=Cu(OH)2↓ |
| D、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3和48gO2含有的氧原子数均为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、11.2L氧气中所含有的原子数为NA |
| D、标准状况下,22.4 L水所含分子数为NA |
Se是人体必需的微量元素,其中
Se的原子棱内中子数是( )
80 34 |
| A、80 | B、46 | C、34 | D、12 |
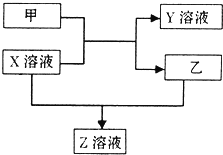 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
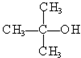 ③
③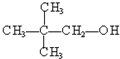 ④
④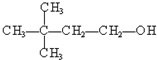 ⑤
⑤
 )
)