题目内容
下列说法不正确的是( )
| A、使用分光光度计,可以换算得到某溶液的浓度 |
| B、氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液(或去离子水) |
| C、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| D、1fs(飞秒)=10-12s(秒) |
考点:氯碱工业,反应热和焓变
专题:化学反应中的能量变化,电化学专题
分析:A.分光光度计就是利用分光光度法对物质进行定量定性分析的仪器;
B.电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;阳离子交换膜只允许阳离子通过,而阴离子不能通过,据此进行判断;
C.H2O(l)=H2O(s)△H<0,液态水到固态水,放热,所以水的能量高;
D.根据1皮秒=10-12s、1fs=10-12s进行判断.
B.电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;阳离子交换膜只允许阳离子通过,而阴离子不能通过,据此进行判断;
C.H2O(l)=H2O(s)△H<0,液态水到固态水,放热,所以水的能量高;
D.根据1皮秒=10-12s、1fs=10-12s进行判断.
解答:
解:A.分光光度计采用一个可以产生多个波长的光源,通过系列分光装置,从而产生特定波长的光源,光线透过测试的样品后,部分光线被吸收,计算样品的吸光值,从而转化成样品的浓度.样品的吸光值与样品的浓度成正比,故A正确;
B.阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室;阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故B正确;
C.根据H2O(l)=H2O(s)△H<0可知,液态水到固态水,放出热量,所以水的能量高,故C正确;
D.1fs(飞秒)=10-15s(秒),故D错误;
故选D.
B.阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室;阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故B正确;
C.根据H2O(l)=H2O(s)△H<0可知,液态水到固态水,放出热量,所以水的能量高,故C正确;
D.1fs(飞秒)=10-15s(秒),故D错误;
故选D.
点评:本题考查了氯碱工业的反应原理、物质状态与能量等知识,题目难度中等,注意掌握电解原理、氯碱工业中阴阳两极反应,明确物质能量与物质所处状态关系,选项D为易错点,注意飞秒、皮秒与秒之间的关系.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
将AlCl3溶液中的Al3+沉淀出来,最好加入的试剂是( )
| A、氨水 |
| B、NaOH溶液 |
| C、Na2SO4溶液 |
| D、AgNO3溶液 |
制备乙酸乙酯的绿色合成路线之一为:
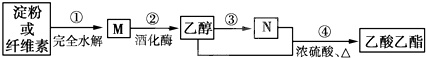
下列说法不正确的是( )

下列说法不正确的是( )
| A、M的分子式为C6H12O6 |
| B、用NaOH溶液可除去乙酸乙酯中混有的乙酸 |
| C、①、④的反应类型均属于取代反应 |
| D、N的化学式为CH3COOH |
X、Y、Z分别是短周期元素的三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平)若X是非金属,则组成Y单质的元素在周期表中的位置是( )
(1)X+Z→N; (2)M+X→N; (3)M+Y→R+X.
(1)X+Z→N; (2)M+X→N; (3)M+Y→R+X.
| A、第二周期ⅣA族 |
| B、第二周期ⅥA族 |
| C、第三周期ⅡA族 |
| D、第三周期ⅣA族 |
常温下,将amol/LNaHCO3与bmol/LNaOH溶液(0<a<0.1;0<b<0.1)等体积混合.下列有关混合溶液的推论正确的是( )
| A、若a=b,则c(OH-)=c(H+)+c(H2CO3)+c(HCO3-) | ||
| B、若a=2b,则c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C、若b=2a,则c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | ||
D、若
|