题目内容
已知晶体CaF2结构如图Ⅰ所示,图Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合),金属铜形成晶体的结构如Ⅲ所示.
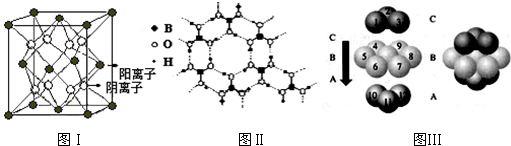
(1)图Ⅲ中铜原子形成的晶体中铜原子的配位数为 .
(2)图II所示的物质结构中最外能层已达8电子结构的原子是 ,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为 .
(3)图I 中CaF2晶体的密度为a g?cm-3,则晶胞的体积是 cm3(只要求列出计算式,阿伏加德罗常数用NA表示).

(1)图Ⅲ中铜原子形成的晶体中铜原子的配位数为
(2)图II所示的物质结构中最外能层已达8电子结构的原子是
(3)图I 中CaF2晶体的密度为a g?cm-3,则晶胞的体积是
考点:晶胞的计算,配合物的成键情况
专题:化学键与晶体结构
分析:(5)金属铜采用面心立方最密堆积,其配位数=3×8×
;
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
(7)根据体积的计算公式V=
进行计算.
| 1 |
| 2 |
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
(7)根据体积的计算公式V=
| m |
| ρ |
解答:
(1)金属铜采用面心立方最密堆积,其配位数=3×8×
=12;
故答案为:12;
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体为分子晶体,受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
故答案为:O;范德华力和氢键;
(3)该晶胞中F离子个数=8,钙离子个数=6×
+8×
=4,则V=
=
cm3=
cm3,
故答案为:
.
| 1 |
| 2 |
故答案为:12;
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体为分子晶体,受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
故答案为:O;范德华力和氢键;
(3)该晶胞中F离子个数=8,钙离子个数=6×
| 1 |
| 2 |
| 1 |
| 8 |
| m |
| ρ |
| ||
| a |
| 312 |
| aNA |
故答案为:
| 312 |
| aNA |
点评:本题考查了涉及晶胞的计算,晶胞的计算利用均摊法解答,要熟练掌握,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、使用分光光度计,可以换算得到某溶液的浓度 |
| B、氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液(或去离子水) |
| C、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| D、1fs(飞秒)=10-12s(秒) |
下列与有机物结构、性质相关的叙述错误的是( )
| A、葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 |
| B、乙烯中含有SO2,将其通入装有KMnO4溶液的洗气瓶中进行洗气 |
| C、鸡蛋清溶液加入食盐,会使蛋白质变性 |
| D、苯、乙酸、乙酸乙酯都能发生取代反应 |
有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出(标准状况下)氢气22.4L,据此推断乙可能是( )
| A、CH3CHOHCHOHCH3 |
| B、HOCH2CHOHCH3 |
| C、CH3CH2CH2OH |
| D、CH3CHOHCH3 |
下列实验过程中,始终无明显现象的是( )
| A、NH3通入AlCl3溶液中 |
| B、CO2通入到CaCl2溶液中 |
| C、用脱脂棉包裹Na2O2粉末露置在潮湿空气中 |
| D、稀盐酸滴加到Fe(OH)3胶体溶液中 |
下列说法不正确的是( )
| A、Na2O2能与CO2反应,可用作呼吸面具的供氧剂 |
| B、SiO2有导电性,可用于制备光导纤维 |
| C、硅胶常用作实验室和食品、药品等的干燥剂,也可作催化剂载体 |
| D、小苏打是一种膨松剂,可用于制作馒头和面包 |