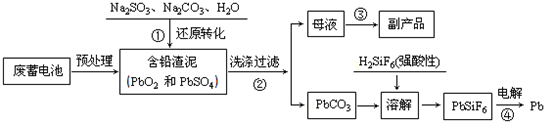
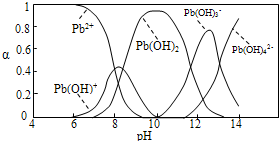
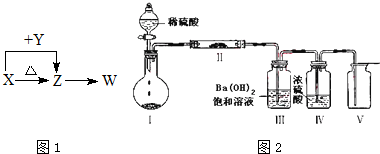
题目内容
Ⅰ.你见过翩翩起舞的鸡蛋吗?请看以下小实验.(已知白醋浓度比普通食醋浓度大)
甲组:一个鸡蛋、一瓶普通食醋、一个玻璃杯.
乙组:一个鸡蛋、一瓶白醋、一个玻璃杯.
操作:(1)将醋倒入玻璃杯内.(2)把鸡蛋放入杯中.(3)仔细观察,刚开始时鸡蛋沉在水底,可是过了一会儿,鸡蛋周围会出现许多小气泡,这些气泡伴着鸡蛋旋转上升,好像鸡蛋在“跳舞”一样.乙组鸡蛋“舞”的比甲组的要剧烈一些.同学们根据以上现象提出了推测:醋酸的浓度越大,鸡蛋“舞”的就越剧烈.于是就换用了冰醋酸(纯净的醋酸).结果鸡蛋在其中却一点也没有“舞”起来.请回答:
(1)写出鸡蛋周围会出现许多小气泡发生的有关离子方程式
(2)为什么换用了冰醋酸,鸡蛋却一点也没有“舞”起来?
Ⅱ.可用于分离或者提纯物质的方法有:A.过滤 B.升华 C.加热分解 D.洗气法
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
(3)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用 .
(4)除去O2中少量的水蒸气,用 .
(5)除去固体碘中混有的少量NaI,用 .
(6)除去KCl中的KClO3,用 .
甲组:一个鸡蛋、一瓶普通食醋、一个玻璃杯.
乙组:一个鸡蛋、一瓶白醋、一个玻璃杯.
操作:(1)将醋倒入玻璃杯内.(2)把鸡蛋放入杯中.(3)仔细观察,刚开始时鸡蛋沉在水底,可是过了一会儿,鸡蛋周围会出现许多小气泡,这些气泡伴着鸡蛋旋转上升,好像鸡蛋在“跳舞”一样.乙组鸡蛋“舞”的比甲组的要剧烈一些.同学们根据以上现象提出了推测:醋酸的浓度越大,鸡蛋“舞”的就越剧烈.于是就换用了冰醋酸(纯净的醋酸).结果鸡蛋在其中却一点也没有“舞”起来.请回答:
(1)写出鸡蛋周围会出现许多小气泡发生的有关离子方程式
(2)为什么换用了冰醋酸,鸡蛋却一点也没有“舞”起来?
Ⅱ.可用于分离或者提纯物质的方法有:A.过滤 B.升华 C.加热分解 D.洗气法
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
(3)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用
(4)除去O2中少量的水蒸气,用
(5)除去固体碘中混有的少量NaI,用
(6)除去KCl中的KClO3,用
考点:乙酸的化学性质,物质的分离、提纯和除杂
专题:实验题
分析:Ⅰ.(1)鸡蛋壳的主要成分为碳酸钙,食醋的主要成分为醋酸,在离子反应中均应保留化学式,反应生成醋酸钙、水、二氧化碳;
(2)CaCO3+2H+═Ca2++H2O+CO2↑,没有水冰醋酸不能电离出H+;
Ⅱ.分离和提纯物质的方法很多,过滤是不溶性固体与液体的分离,加热分解是利用物质的不稳定性来分离,升华是利用物质在加热时由固体直接变为气体的性质来分离,洗气法可利用吸水性或物质之间的反应来分析的物质分离方法.
(2)CaCO3+2H+═Ca2++H2O+CO2↑,没有水冰醋酸不能电离出H+;
Ⅱ.分离和提纯物质的方法很多,过滤是不溶性固体与液体的分离,加热分解是利用物质的不稳定性来分离,升华是利用物质在加热时由固体直接变为气体的性质来分离,洗气法可利用吸水性或物质之间的反应来分析的物质分离方法.
解答:
解:Ⅰ.(1)鸡蛋壳的主要成分为碳酸钙,食醋的主要成分为醋酸,在离子反应中均应保留化学式,反应生成醋酸钙、水、二氧化碳,其离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,
故答案为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
(2)鸡蛋会在醋酸溶液中“跳舞”,是因为醋酸在水溶液中电离出的H+会与鸡蛋壳的主要成分CaCO3发生反应:CaCO3+2H+═Ca2++H2O+CO2↑.生成的CO2会“吹”动鸡蛋“跳舞”.醋酸的浓度越大,电离出的H+浓度就会越大,反应就会越快,鸡蛋“舞”的就越剧烈.换用冰醋酸后,由于没有水的存在,醋酸自然也就不会电离出H+,也就没有了CaCO3与H+的反应,鸡蛋因此就“舞”不起来了;
故答案为:换用冰醋酸后,由于没有水的存在,醋酸不会电离出H+,就没有了CaCO3与H+的反应,鸡蛋因此就“舞”不起来了;
Ⅱ.(3)除去石灰水中悬浮的CaCO3颗粒,根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法,故答案为:A;
(4)浓硫酸具有吸水性且与氧气不反应,可以用浓硫酸来洗气,故答案为:D;
(5)碘单质受热易升华,而碘化钠受热稳定,可以用加热升华法来分离,故答案为:B;
(6)氯酸钾受热分解为氯化钾和氧气,可用加热分解法来除去KCl中的KClO3,故答案为:C.
故答案为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
(2)鸡蛋会在醋酸溶液中“跳舞”,是因为醋酸在水溶液中电离出的H+会与鸡蛋壳的主要成分CaCO3发生反应:CaCO3+2H+═Ca2++H2O+CO2↑.生成的CO2会“吹”动鸡蛋“跳舞”.醋酸的浓度越大,电离出的H+浓度就会越大,反应就会越快,鸡蛋“舞”的就越剧烈.换用冰醋酸后,由于没有水的存在,醋酸自然也就不会电离出H+,也就没有了CaCO3与H+的反应,鸡蛋因此就“舞”不起来了;
故答案为:换用冰醋酸后,由于没有水的存在,醋酸不会电离出H+,就没有了CaCO3与H+的反应,鸡蛋因此就“舞”不起来了;
Ⅱ.(3)除去石灰水中悬浮的CaCO3颗粒,根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法,故答案为:A;
(4)浓硫酸具有吸水性且与氧气不反应,可以用浓硫酸来洗气,故答案为:D;
(5)碘单质受热易升华,而碘化钠受热稳定,可以用加热升华法来分离,故答案为:B;
(6)氯酸钾受热分解为氯化钾和氧气,可用加热分解法来除去KCl中的KClO3,故答案为:C.
点评:本题考查离子反应方程式的书写和物质分离提纯的方法,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,题目难度不大,注意在离子反应中保留化学式的物质.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在氧化还原原理上最相似的反应是( )
| A、2NaBr+Cl2═2NaCl+Br2 | ||||
B、2KMnO4
| ||||
| C、2H2S+SO2═3S↓+2H2O | ||||
| D、2FeCl3+H2S═2FeCl2+S↓+2HCl |
常温下,一定体积pH=2的二元弱酸H2R溶液与一定体积pH=12的NaOH溶液混合后溶液呈中性.该混合溶液中,离子浓度关系正确的是( )
| A、c(Na+)=2c(R2-)+c(HR-) |
| B、c(Na+)=10-2mol/L |
| C、c(R2-)+c(OH-)+c(HR-)=C(Na+)+C(H+) |
| D、c(R2-)>c(Na+)>c(H+)>c(OH-) |