题目内容
分别取一定量的A和B置于容器中,发生可逆反应2A(g)+B(g)?2C( g)+2D(g),4s后,测得容器内C的浓度为0.8mol/L.
(1)若以C、B来表示该反应的平均速率应分别为多少?
(2)此时D的浓度为多少?
(1)若以C、B来表示该反应的平均速率应分别为多少?
(2)此时D的浓度为多少?
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:(1)依据化学反应速率概念分析计算,反应速率△V=
计算C的反应速率,反应速率之比等于化学方程式计量数之比计算B的反应速率;
(2)依据生成C的物质的量浓度计算生成D物质的量浓度.
| △c |
| △t |
(2)依据生成C的物质的量浓度计算生成D物质的量浓度.
解答:
解:分别取一定量的A和B置于容器中,发生可逆反应2A(g)+B(g)?2C( g)+2D(g),4s后,测得容器内C的浓度为0.8mol/L
(1)用C表示的反应速率V(C)=
=0.2mol/L?s;
反应速率之比等于化学方程式计量数之比,V(B)=
V(C)=
×0.2mol/L?s=0.1mol/L?s,
答:以C、B来表示该反应的平均速率应分别为0.2mol/L?s、0.1mol/L?s;
(2)反应过程中生成C浓度为0.8mol/L,依据化学方程式计算可知D的浓度为0.8mol/L,
答:此时D的浓度为0.8mol/L.
(1)用C表示的反应速率V(C)=
| 0.8mol/L |
| 4s |
反应速率之比等于化学方程式计量数之比,V(B)=
| 1 |
| 2 |
| 1 |
| 2 |
答:以C、B来表示该反应的平均速率应分别为0.2mol/L?s、0.1mol/L?s;
(2)反应过程中生成C浓度为0.8mol/L,依据化学方程式计算可知D的浓度为0.8mol/L,
答:此时D的浓度为0.8mol/L.
点评:本题考查了化学平衡计算方法,反应速率概念的计算应用,注意反应速率之比等于化学方程式计量数之比的计算应用,题目较简单.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B、能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C、取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D、H++OH-═H2O可描述所有酸碱中和反应的实质 |
下列实验操作中,不符合操作规范的是( )
A、 渗析 |
B、 定容 |
C、 过滤 |
D、 闻Cl2的气味 |
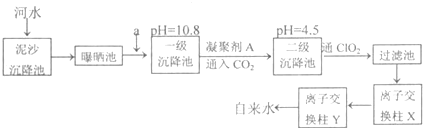
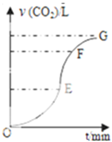 用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).
用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).