题目内容
常温下,一定体积pH=2的二元弱酸H2R溶液与一定体积pH=12的NaOH溶液混合后溶液呈中性.该混合溶液中,离子浓度关系正确的是( )
| A、c(Na+)=2c(R2-)+c(HR-) |
| B、c(Na+)=10-2mol/L |
| C、c(R2-)+c(OH-)+c(HR-)=C(Na+)+C(H+) |
| D、c(R2-)>c(Na+)>c(H+)>c(OH-) |
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:常温下,pH=2的二元弱酸H2R溶液中H2R的浓度大于0.01mol/L,pH=12的NaOH溶液中NaOH浓度为0.01mol/L,二者混合溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒和物料守恒.
解答:
解:常温下,pH=2的二元弱酸H2R溶液中H2R的浓度大于0.01mol/L,pH=12的NaOH溶液中NaOH浓度为0.01mol/L,二者混合溶液呈中性,则c(H+)=c(OH-),
A.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),所以得c(Na+)=2c(R2-)+c(HR-),故A正确;
B.二者混合后溶液体积大于氢氧化钠溶液体积,所以混合溶液中c(Na+)<10-2mol/L,故B错误;
C.溶液中存在电荷守恒2c(R2-)+c(OH-)+c(HR-)=c(Na+)+c(H+),故C错误;
D.二者混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),所以得c(Na+)=2c(R2-)+c(HR-),则c(R2-)<c(Na+),故D错误;
故选A.
A.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),所以得c(Na+)=2c(R2-)+c(HR-),故A正确;
B.二者混合后溶液体积大于氢氧化钠溶液体积,所以混合溶液中c(Na+)<10-2mol/L,故B错误;
C.溶液中存在电荷守恒2c(R2-)+c(OH-)+c(HR-)=c(Na+)+c(H+),故C错误;
D.二者混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),所以得c(Na+)=2c(R2-)+c(HR-),则c(R2-)<c(Na+),故D错误;
故选A.
点评:本题以酸碱混合溶液定性判断为载体考查了离子浓度大小比较,根据溶液酸碱性再结合电荷守恒来分析解答,灵活运用守恒思想解答,题目难度不大.

练习册系列答案
相关题目
 膳食纤维具有突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图,下列有关芥子醇说法正确的是( )
膳食纤维具有突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图,下列有关芥子醇说法正确的是( )| A、芥子醇的分子式是C11H12O4 |
| B、芥子醇能与FeCl3溶液发生显色反应 |
| C、芥子醇分子中所有碳原子不可能在同一平面 |
| D、1mol芥子醇能与足量溴水反应消耗1molBr2 |
下列说法中正确的是( )
| A、某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B、能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C、取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D、H++OH-═H2O可描述所有酸碱中和反应的实质 |
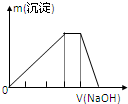 某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )
某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )| A、Na+、H+、Cl-、NO3- |
| B、K+、Ba2+、OH-、I- |
| C、Mg2+、Fe3+、Br-、HCO3- |
| D、Na+、Mg2+、Cl-、AlO2- |
下列说法中正确的是( )
| A、硫酸的摩尔质量是98g |
| B、2mol水的质量是18g/mol |
| C、氯化氢的摩尔质量等于它的相对分子质量 |
| D、22g二氧化碳的物质的量是0.5mol |
下列醇可以发生消去反应且所得产物无同分异构体的是( )
A、 |
B、 |
| C、CH3OH |
D、 |
下列实验操作中,不符合操作规范的是( )
A、 渗析 |
B、 定容 |
C、 过滤 |
D、 闻Cl2的气味 |