题目内容
8.实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,实验过程如图1: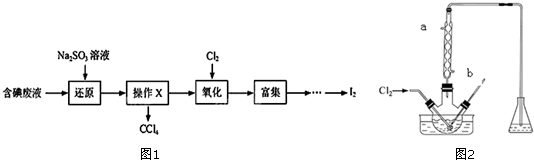
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为SO32-+I2+H2O=2I-+2H++SO42-;该操作将I2还原为I-的目的是使四氯化碳中的碘进入水层.
(2)操作X的名称为分液.
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图2所示).装置的冷凝管的入水口应从b(填a或b)进水,此实验控制在较低温度下进行的原因是使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);锥形瓶里盛放溶液作用的为NaOH溶液.
(4)已知:5SO32-+2IO3-+2H+═I2+5SO42-+H2O.某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种.请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有IO3-的方法是从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-.(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
分析 碘废液加亚硫酸钠溶液,把单质碘还原为I-,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化I-得到I2,富集,最后得到较纯的I2,
(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘不容易溶于水,但碘离子易溶于水;
(2)分离互不相溶的液体采用分液的方法分离;
(3)根据逆流的冷凝的效果好判断进水口;碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色.
解答 解:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘不容易溶于水,但碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子,
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘进入水层;
(2)四氯化碳属于有机物、水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,故答案为:分液;
(3)根据逆流的冷凝的效果好可知进水口为b,碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:b;使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液;
(4)碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2 IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,
故答案为:从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-.
点评 本题以物质的制备为载体考查了氧化还原反应、离子的检验、物质的分离和提纯,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.

| A. | 含ClO-的溶液中:Fe3+、S042-、NO3-、K+ | |
| B. | 使石蕊试液显红色的溶液中:Fe2+、K+、NO3-、CI- | |
| C. | 在c(H+):c(OH-)=1:1012的溶液中,Na+、I-、NO3-、SO42- | |
| D. | 能使有色布条褪色的溶液:K+、S032-、NO3-、Mg2+ |
| A. | NH4Br: | B. | CaCl2: | ||
| C. | Na2O2: | D. | N2:N??N |

| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法确定 |
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 原子序数 |
| A. | Na2O2 Na2O | B. | KClO NaOH | C. | Br2 HBr | D. | HF H2O |
 .
. (1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: