题目内容
8.向8g某+2价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗的硫酸体积为100mL,在所得溶液中插入铂电极进行电解,一定时间后,在一个电极上收集到标准状况下224mL氧气,在另一个电极上得到1.28g金属.(1)根据计算确定金属的名称.
(2)计算通电后所得硫酸溶液的物质的量浓度(溶液体积按100mL计算).
分析 (1)依据电解过程中电子守恒,结合氧气生成的电极反应计算电子转移物质的量,依据析出金属质量和物质的量计算摩尔质量,分析判断金属;
(2)依据电子守恒计算电解过程中氢氧根离子减小和溶液中氢离子增加物质的量相同计算电解后溶液的酸溶液浓度.
解答 解:(1)n(O2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则转移电子n(e-)=0.01×4=0.04mol,依据电子得失守恒及+2价金属,所以n(金属)=0.02mol,n=$\frac{m}{M}$得到,M=$\frac{1.28g}{0.02mol}$=64g/mol;则该金属的名称为铜,
答:该金属的名称为铜;
(2)依据反应4OH--4e-=O2↑+2H2O可知每转移4个电子会产生4个氢离子,由于n(e-)=0.04mol,得到n(H+)=0.04mol,c(H2SO4)=$\frac{n}{V}$=$\frac{0.02mol}{0.1L}$=0.2mol/L,
答:通电后硫酸溶液的物质的量浓度为0.2mol/L.
点评 本题考查了电解池原理分析,电解过程中电子守恒,电极反应的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
18.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如下操作:
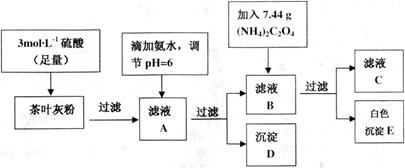
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
实验前要先将茶叶样品高温灼烧成灰粉,需用到的仪器有①③④⑤.
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
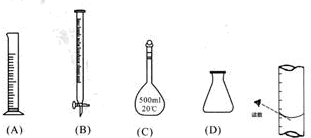
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;
②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;

②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.
16.CuO、Fe铁粉、Fe3O4的混合物中,加一定量稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液中插入一枚铁钉,片刻后.取出铁钉,发现铁钉并无变化,相据上述现象,确定下面结论中正确的是( )
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe2(SO4)3,但不一定含有FeSO4 |
3.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 1mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |
20.下列实验操作中正确的是( )
| A. | 用浓硫酸配制稀硫酸时,浓硫酸缓慢加入水中,并用玻璃棒不断搅拌 | |
| B. | 用酒精和汽油都可以萃取碘水中的碘 | |
| C. | 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
10.化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯.

已知:
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从g口进入(填“g”或“f”).蒸馏时要加入生石灰,其目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是BC.
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点.

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从g口进入(填“g”或“f”).蒸馏时要加入生石灰,其目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是BC.
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点.
 ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应. )与乙醇(
)与乙醇( )反应生成酯(
)反应生成酯( )和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式:
)和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式: +CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.
+CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.