题目内容
在一定温度下,测得0.1mol?L-1CH3COOH溶液的PH为3.0.则CH3COOH在水中的电离度为 ,此温度CH3COOH的电离平衡常数为 .
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:电离度α=
×100%;CH3COOH的电离平衡常数Ka=
,以此解答该题.
| 已电离的醋酸分子 |
| 醋酸分子总数 |
| C(H+).C(CH3COO-) |
| C(CH3COOH) |
解答:
解:(1)由CH3COOH?CH3COO-+H+知,c(H+)等于已经电离的c(CH3COOH),所以已经电离的醋酸浓度是1.0×10-3mol/L,
所以α=
×100%=
×100%=1%;
由CH3COOH?CH3COO-+H+知,c(H+)=c(CH3COO-)=已经电离的c(CH3COOH),
溶液中未电离的醋酸浓度为(0.1-0.001)mol/L,
Ka=
=
=10-5,
故答案为:1%;10-5.
所以α=
| 已电离的醋酸分子 |
| 醋酸分子总数 |
| 1×10-3mol/L |
| 0.1mol/L |
由CH3COOH?CH3COO-+H+知,c(H+)=c(CH3COO-)=已经电离的c(CH3COOH),
溶液中未电离的醋酸浓度为(0.1-0.001)mol/L,
Ka=
| C(H+).C(CH3COO-) |
| C(CH3COOH) |
| 0.001×0.001 |
| 0.1 |
故答案为:1%;10-5.
点评:本题考查了弱电解质的电离平衡、电离度和电离常数的计算等知识点,明确弱电解质电离平衡特点及有关计算公式是解本题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(1)写出NaHSO4的电离方程式 ;
(2)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式 .
(3)写出碳酸钙与盐酸反应的离子方程式 .
(2)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式
(3)写出碳酸钙与盐酸反应的离子方程式
某化学反应的△H=+122kJ?mol-1,△S=-231J?mol-1?K-1,则此反应在下列哪种情况下可自发进行( )
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
已知氮的氧化物和NaOH 溶液发生的化学反应如下:3NO2+2NaOH=2NaNO3+NO↑+H2O NO2+NO+2NaOH=2NaNO2+H2O
现有m mol NO2 和 n mol NO 组成的混合气体,用VLNaOH 溶液恰好使其完全吸收无气体剩余,则此NaOH溶液浓度为( )
现有m mol NO2 和 n mol NO 组成的混合气体,用VLNaOH 溶液恰好使其完全吸收无气体剩余,则此NaOH溶液浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
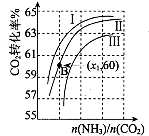 用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比
用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比