题目内容
(1)写出NaHSO4的电离方程式 ;
(2)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式 .
(3)写出碳酸钙与盐酸反应的离子方程式 .
(2)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式
(3)写出碳酸钙与盐酸反应的离子方程式
考点:离子方程式的书写,电离方程式的书写
专题:离子反应专题
分析:(1)硫酸氢钠在水溶液里完全电离生成钠离子、硫酸根离子和氢离子;
(2)原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水;
(3)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水.
(2)原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水;
(3)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水.
解答:
解:(1)硫酸氢钠在水溶液里完全电离生成钠离子、硫酸根离子和氢离子,电离方程式为NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2)原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水,离子方程式为H++SO42-+OH-+Ba2+=BaSO4+H2O,故答案为:H++SO42-+OH-+Ba2+=BaSO4+H2O;
(3)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑.
(2)原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水,离子方程式为H++SO42-+OH-+Ba2+=BaSO4+H2O,故答案为:H++SO42-+OH-+Ba2+=BaSO4+H2O;
(3)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑.
点评:本题考查了离子方程式和电离方程式的书写,明确物质的性质及离子方程式和电离方程式书写规则即可解答,注意强弱电解质电离方式的区别,注意离子方程式中气体、沉淀、弱电解质、氧化物等要写化学式,注意硫酸氢钠在水溶液里和熔融状态下电离方式的区别,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B、用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| C、石油的分馏是物理变化,而煤的干馏是化学变化 |
| D、将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
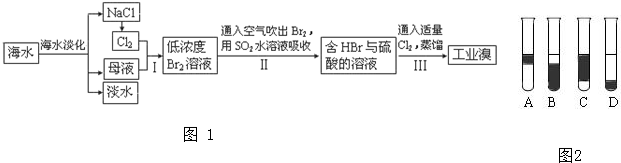
 (1)铁、铝、铜是人类使用广泛的三种金属.
(1)铁、铝、铜是人类使用广泛的三种金属.
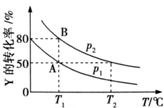 在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.
在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示. 是一种驱虫药--山道年的结构简式.试确定其分子式为
是一种驱虫药--山道年的结构简式.试确定其分子式为