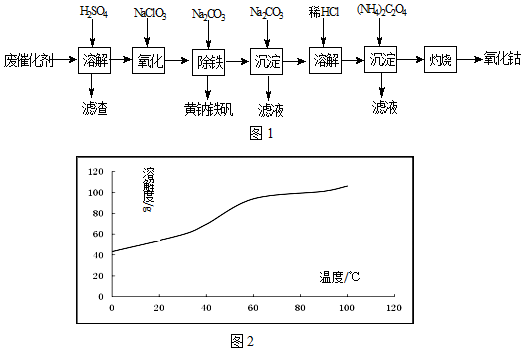
题目内容
14.下列说法正确的是( )| A. | 某溶液加入足量硝酸银溶液产生白色沉淀,证明其中一定存在Cl- | |
| B. | 某溶液加入足量稀盐酸无现象,再加入BaCl2产生白色沉淀,证明其中一定存在SO42- | |
| C. | 某溶液加人稀盐酸产生无色、无味能使澄请石灰水变混浊的气体,证明其中一定存在CO32- | |
| D. | 向品红溶液中通入某气体后,品红溶液红色消失,证明该气体一定是SO2 |
分析 A.某溶液加入足量硝酸银溶液产生白色沉淀,可能为氯离子、硫酸根离子、碳酸根离子等;
B.硫酸根离子检验方法是加入盐酸排除其他离子干扰,再加入氯化钡生成沉淀检验;
C.和盐酸反应的离子为碳酸根离子或碳酸氢根离子;
D.二氧化硫其他检验时通入品红溶液褪色,加热恢复红色.
解答 解:A.某溶液加入足量硝酸银溶液产生白色沉淀,不能证明其中一定存在Cl-,可能是生成了硫酸银、碳酸银等白色沉淀,故A错误;
B.向某无色溶液中加入足量盐酸酸化,无现象,说明溶液中没有银离子,再加BaCl2溶液,产生白色沉淀,说明原溶液中存在SO42-.故B正确;
C.某溶液加人稀盐酸产生无色、无味能使澄请石灰水变混浊的气体,不能证明其中一定存在CO32-,可能为HCO3-,故C错误;
D.向品红溶液中通入某气体后,品红溶液红色消失,不能证明该气体一定是SO2 ,氯气等氧化性其他也可以使品红溶液褪色,故D错误;
故选B.
点评 本题考查了气体检验、气体特征性质、离子检验和反应现象的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
4.利用反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746,8kJ•mol-1,可净化汽车尾气,如果要同时提高反应的速率和 NO 的转化率,采取的措施是( )
| A. | 降低温度 | |
| B. | 升高温度同时充入N2 | |
| C. | 增大压强 | |
| D. | 及时将 CO2和 N2 从反应体系中移走 |
5.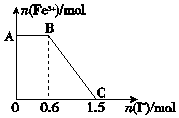 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.15 mol | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:6 |
2. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 若Z是KCl溶液,则电解时溶液中Cl-向Y极移动 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 外加电流的阴极保护法中,Y是待保护金属 | |
| D. | 电解硫酸溶液一段时间后,加适量水可使溶液恢复到原溶液 |
3.下列说法中不正确的是( )
| A. | 每种烃的含氧衍生物中至少有3种元素 | |
| B. | 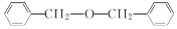 中含有的官能团为醚基 中含有的官能团为醚基 | |
| C. | 所有的有机物中都含有碳,多数含氢,其次还含有氧、氮、卤素、硫、磷等 | |
| D. | 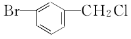 属于芳香卤代烃 属于芳香卤代烃 |
 .
.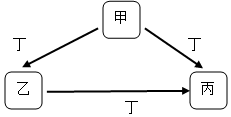 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).