题目内容
5.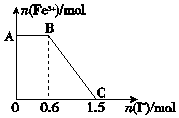 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.15 mol | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:6 |
分析 氧化性强弱顺序为K2Cr2O7>Fe3+,由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒解答该题.
解答 解:A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;
B.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故B正确;
C.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为$\frac{1.5}{6}$mol=0.25mol,故C错误;
D.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误.
故选CD.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的相关方程式的书写,根据方程式、关系式及电子守恒计算该题,难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
15. 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1 mol 化学键时所需吸收的能量.表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1 mol 化学键时所需吸收的能量.表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图所示,则表中X=433.75kJ•mol-1.
 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1 mol 化学键时所需吸收的能量.表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1 mol 化学键时所需吸收的能量.表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
16.卤素互化物(XX′n)的性质与卤素单质相似,其中非金属性:X<X′.已知反应如下:3H2O+2ICl3=5HCl+ICl+HIO3.则下列判断正确的是( )
| A. | XX′n 属于活泼非金属单质 | |
| B. | ICl3 属于共价化合物 | |
| C. | 上述反应中HCl是还原产物 | |
| D. | ICl溶于水的反应:ICl+H2O=HIO+HCl 不属于氧化还原反应 |
13.下列说法不正确的是( )
①CH3-CH=CH2和CH2=CH2的最简式相同 ②、CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物 ④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤在氧气中燃烧只生成二氧化碳和水的有机化合物一定是烃
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法.
①CH3-CH=CH2和CH2=CH2的最简式相同 ②、CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物 ④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤在氧气中燃烧只生成二氧化碳和水的有机化合物一定是烃
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法.
| A. | ①和⑤ | B. | ②和③ | C. | ③⑤和⑥ | D. | ④和⑥ |
17.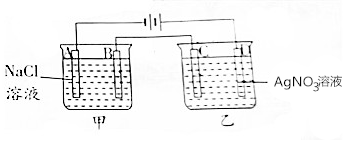 按如图进行电解实验(A,B,C,D均为惰性电极).
按如图进行电解实验(A,B,C,D均为惰性电极).
电极反应式:
A极:2H++2e-═H2↑;
B极:2Cl--2e-=Cl2↑;
C极:Ag++e-═Ag;
D极:4OH--4e-═2H2O+O2↑.
 按如图进行电解实验(A,B,C,D均为惰性电极).
按如图进行电解实验(A,B,C,D均为惰性电极).电极反应式:
A极:2H++2e-═H2↑;
B极:2Cl--2e-=Cl2↑;
C极:Ag++e-═Ag;
D极:4OH--4e-═2H2O+O2↑.
14.下列说法正确的是( )
| A. | 某溶液加入足量硝酸银溶液产生白色沉淀,证明其中一定存在Cl- | |
| B. | 某溶液加入足量稀盐酸无现象,再加入BaCl2产生白色沉淀,证明其中一定存在SO42- | |
| C. | 某溶液加人稀盐酸产生无色、无味能使澄请石灰水变混浊的气体,证明其中一定存在CO32- | |
| D. | 向品红溶液中通入某气体后,品红溶液红色消失,证明该气体一定是SO2 |
2.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 偏铝酸钠溶液:K+、NO3-、NH3•H2O | |
| B. | 空气:C2H6、CO2、SO2、NO | |
| C. | 硫酸铜溶液:H+、K+、S2-、Br- | |
| D. | 重铬酸钾钾溶液:H+、Na+、SO42-、乙醛分子 |