题目内容
6.下列物质不能通过化合反应制得的是( )| A. | SO3 | B. | Na2O2 | C. | Al(OH)3 | D. | NO |
分析 A.二氧化硫和氧气催化氧化生成三氧化硫;
B.钠和氧气点燃反应生成过氧化钠;
C.氢氧化铝不能通过化合反应生成;
D.氮气和氧气放电反应生成一氧化氮.
解答 解:A.二氧化硫和氧气催化氧化生成三氧化硫,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,能通过化合反应制得,故A不符合;
B.钠和氧气点燃反应生成过氧化钠,2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,能通过化合反应制得,故B不符合;
C.氧化铝不溶于水,氢氧化铝不能一步通过化合反应生成,不能通过化合反应制得,故C符合;
D.一氧化氮可以利用氧气和氮气化合反应生成,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,能通过化合反应制得,故D不符合;
故选C.
点评 本题考查物质的性质以及化合反应的概念知识,注意知识的归纳和整理是关键,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
16.欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的混合物分离,最合理的操作顺序是( )
| A. | 溶解、过滤、加热(升华)、蒸发(结晶) | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 升华、溶解、蒸馏、结晶 | D. | 溶解、结晶、过滤、升华 |
17.下列四种物质,不能由金属与非金属两种单质直接化合生成的是( )
| A. | FeCl2 | B. | Fe3O4 | C. | Al2O3 | D. | CuCl2 |
14.下列物质的化学式与俗称不相符的是( )
| A. | Na2CO3-苏打 | B. | BaCO3-重金石 | C. | NH4NO3-硝铵 | D. | NaOH-火碱 |
1.有5种溶液,他们分别是:①KNO3;②BaCl2;③NaOH;④(NH4)2SO4;⑤CuCl2,若要求不用任何外加试剂鉴别它们,则鉴别的先后顺序正确的是( )
| A. | ⑤④①③② | B. | ⑤③④②① | C. | ②④③①⑤ | D. | ③②④⑤① |
18.短周期主族元素X,Y,Z,W,Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
15.下列说法正确的是( )
| A. | 常温下将pH=2的硫酸和pH=12的MOH溶液等体积混合,所得溶液pH≤7 | |
| B. | 已知同温度相同浓度的NaNO2溶液比NaF溶液的碱性强,所以氢氟酸的酸性比亚硝酸的弱 | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则有c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | pH相等的NH4Cl、(NH4)2SO4、NH4HSO4三种溶液物质的量浓度为c(NH4Cl)>c((NH4)2SO4)=c(NH4HSO4) |
16.铬(Cr)有多种化合物,在工业生产中有广泛的用途.
(1)工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
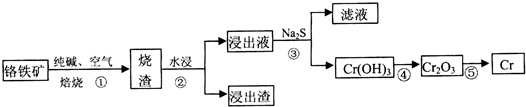 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
b.浸出液中含有的主要成分为Na2CrO4,向滤液中加酸化的氯化钡溶液有白色沉淀生成,则操作③发生反应的离子方程式CrO42-+Ba2+=BaCrO4↓.
(2)铬的化合物有毒,排放前要经过处理,通常用电解法:
将含Cr2O72-的废水放入电解槽内,加入一定量氯化钠,用铁作电极提供Fe2+,Cr2O72-将Fe2+氧化生成Fe3+,本身被还原生成Cr3+,最后Cr3+和Fe3+以Cr(OH)3和Fe(OH)3的形式除去.铁作电解槽的阳极,阴极反应式为2H++2e-=H2↑,Cr2O72-氧化Fe2+的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
(3)CrO3是一种常见的铬的氧化物,其热稳定性较差,加热时逐步分解.取100gCrO3加热,剩余固体的质量随温度的变化如下表所示.
则x=84.00,y为Cr2O5(写化学式).
(1)工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).b.浸出液中含有的主要成分为Na2CrO4,向滤液中加酸化的氯化钡溶液有白色沉淀生成,则操作③发生反应的离子方程式CrO42-+Ba2+=BaCrO4↓.
(2)铬的化合物有毒,排放前要经过处理,通常用电解法:
将含Cr2O72-的废水放入电解槽内,加入一定量氯化钠,用铁作电极提供Fe2+,Cr2O72-将Fe2+氧化生成Fe3+,本身被还原生成Cr3+,最后Cr3+和Fe3+以Cr(OH)3和Fe(OH)3的形式除去.铁作电解槽的阳极,阴极反应式为2H++2e-=H2↑,Cr2O72-氧化Fe2+的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
(3)CrO3是一种常见的铬的氧化物,其热稳定性较差,加热时逐步分解.取100gCrO3加热,剩余固体的质量随温度的变化如下表所示.
| 温度/K | 480 | 505 | 615 | 730 |
| 质量/g | 94.67 | 92.00 | x | 76.00 |
| 化学式 | Cr3O8 | y | CrO2 | Cr2O3 |
