题目内容
2.短周期W、X、Y、Z四种元素的原子序数依次增大.W的某种原子无中子,X、Y形成的简单离子具有相同的电子层结构,且X、Y可形成原子个数比为1:1的具有漂白性的物质,工业上常用电解熔融的YZ来获得Y的单质.下列说法正确的是( )| A. | 上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W) | |
| B. | W和X、Y、Z均能形成18电子的分子 | |
| C. | Y2X和Y2X2中阴、阳离子个数之比均为1:2 | |
| D. | X、Y、Z三种元素形成的化合物,其水溶液一定呈碱性 |
分析 短周期W、X、Y、Z四种元素的原子序数依次增大,W的某种原子无中子,则W为H元素;X、Y形成的简单离子具有相同的电子层结构,且X、Y可形成原子个数比为1:1的具有漂白性的物质,则X为O元素,Y为Na元素;工业上常用电解熔融的NaCl来获得Na的单质,则Z为Cl元素,根据以上分析可知:W为H元素、X为O元素、Y为Na元素、Z为Cl元素,据此分析.
解答 解:短周期W、X、Y、Z四种元素的原子序数依次增大,W的某种原子无中子,则W为H元素;X、Y形成的简单离子具有相同的电子层结构,且X、Y可形成原子个数比为1:1的具有漂白性的物质,则X为O元素,Y为Na元素;工业上常用电解熔融的NaCl来获得Na的单质,则Z为Cl元素,根据以上分析可知:W为H元素、X为O元素、Y为Na元素、Z为Cl元素,
A.四种元素的原子半径大小顺序为r(Na)>r(Cl)>r(O)>r(H),即原子半径大小顺序为r(Y)>r(Z)>r(X)>r(W),故A错误;
B.H和O、Cl均能形成18电子的分子,如H2O2、HCl,H与Na不能形成分子,故B错误;
C.Na2O和Na2O2中阴离子分别为氧离子和过氧根离子、阳离子为钠离子,则阴、阳离子个数之比均为1:2,故C正确;
D.X、Y、Z三种元素形成的化合物,如NaClO4,其水溶液呈中性,故D错误.
故选C.
点评 本题考查位置结构性质的关系及应用,题目难度中等,正确推断元素名称是解题关键,注意根据原子半径确定元素的方法,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下面对氯气的叙述正确的是( )
| A. | 氯气可使湿的红布条褪色,所以氯气具有漂白性 | |
| B. | 氯气没有漂白性,但通入品红溶液中,品红褪色 | |
| C. | 氯气不跟非金属反应 | |
| D. | 氯气有毒,闻其气味时要小心将集气瓶放在鼻孔下直接闻其气味 |
13.以酸性氢氧燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )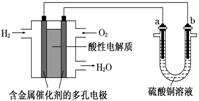

| A. | a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
10.下列有关物质应用正确的是( )
| A. | 氯气、明矾净水原理相同 | |
| B. | 过氧化钠、活性炭均可用于呼吸面具 | |
| C. | 硅胶和铁粉均可用于食品的防氧化 | |
| D. | 甲烷的氯代物均可作防火材料 |
17.根据有机化合物的命名原则,下列命名错误的是( )
| A. | 2,3-二甲基-4-乙基己烷 | B. |  1,2-二甲苯 1,2-二甲苯 | ||
| C. |  甲酸苯酚酯 甲酸苯酚酯 | D. |  苯甲酸甲酯 苯甲酸甲酯 |
14.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
11.化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒 | |
| B. | “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适 | |
| C. | 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 |
12.下列有关化学用语的表示正确的是( )
| A. | N2的电子式: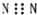 | |
| B. | 甲烷分子的比例模型是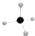 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.