题目内容
15.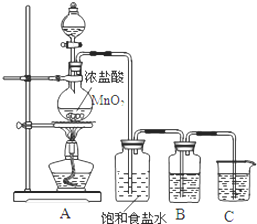 为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置B中盛放的试剂是A(填选项),实验现象为产生淡黄色沉淀,化学反应方程式是Na2S+Cl2=2NaCl+S↓.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(2)装置C中盛放烧碱稀溶液,目的是吸收氯气,防止污染大气.
(3)能证明氯元素比硫元素非金属性强的依据为①③④. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2-比Cl-还原性强;
④HCl比H2S稳定.
(4)若B瓶中盛放KI溶液和CCl4试剂,实验后,振荡、静置,会出现的实验现象下层为紫色,写出反应的离子方程式2I-+Cl2=2Cl-+I2.
分析 (1)从置换反应判断元素非金属性强弱分析,氯气能把硫元素从其硫化钠溶液中置换出来;
(2)氯气为有毒气体,要进行尾气处理;
(3)利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱,以此来解答;
(4)氯气与碘化钾反应生成单质碘.
解答 解:(1)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2-═2Cl-+S↓;反应中有淡黄色沉淀生产;
故答案为:A;产生淡黄色沉淀;Na2S+Cl2=2NaCl+S↓;
(2)氯气为有毒气体,要进行尾气处理,氯气能与氢氧化钠溶液反应,所以装置C中盛放烧碱溶液的作用是吸收氯气,防止污染大气;
故答案为:吸收氯气,防止污染大气;
(3)能证明氯元素比硫元素非金属性强的依据①氯原子比硫原子更容易获得电子形成离子,得电子能力越强非金属性越强,故正确,②通过最高价含氧酸的酸性可以比较非金属性,不能比较其氧化性,故错误③S2-比Cl-还原性强,根据阴离子的还原性越弱非金属性越强来判断,故正确④氢化物越稳定,非金属性越强,故正确,所以①③④,
故答案为:①③④;
(4)氯气与碘化钾反应生成单质碘,加CCl4试剂,溶液会分层,下层为碘单质和CCl4,所以下层呈紫色,其反应的离子方程式为:2I-+Cl2=2Cl-+I2,
故答案为:下层为紫色;2I-+Cl2=2Cl-+I2.
点评 本题应从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合的酸性溶液中:c(NH4+)>2c(SO42-) | |
| C. | 物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的溶液等体积混合后溶液中 c(CH3COOH)+c(CH3COO-)=0.02 mol/L | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中c(NH4+):①>③>② |
10.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
20.某有机物甲经氧化后得到乙(C2H3O2Cl),而甲经水解可得到丙.1mol丙和2mol乙反应可得到一种含氯的酯(C6H8O4Cl2).以此推断甲的结构简式为( )
| A. | Cl-CH2-CH2-OH | B. | Cl-CH2-CHO | C. | HCOOCH2Cl | D. | HO-CH2-CH2OH |
7.一定条件下,2SO2(g)+O2(g)?2SO3(g)△H<0.下列有关叙述正确的是( )
| A. | 升高温度,v(正)变大,v(逆)变小 | |
| B. | 恒温恒容,平衡前后混合气体的密度保持不变 | |
| C. | 恒温恒压,充入N2,平衡不移动 | |
| D. | 恒温恒容,充入O2,O2的转化率升高 |
5.下列有关实验的说法不正确的是( )
| A. | 用广泛pH试纸测得0.05mol•L-1 H2SO4溶液的pH=1 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物一定为钾盐 | |
| C. | 滴定过程中,眼睛要始终注视锥形瓶中液体的颜色变化 | |
| D. | 配制FeSO4溶液时,先将FeSO4固体溶解在稀硫酸中,然后稀释到所需浓度,最后再加入少量铁粉 |
 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题: