题目内容
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | lmolNacl 固体中含有NA个Na+ | |
| B. | 18gD2O和18gH2 O中含有的质子数均为10NA | |
| C. | 标准状况下2.24LH2O 含有的共价键数为0.2NA | |
| D. | 密闭容答中2molNO 与lmolO2充分反应,产物的分子数为2NA |
分析 A、氯化钠由钠离子和氯离子构成;
B、重水的摩尔质量为20g/mol;
C、标况下水为液态;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4.
解答 解:A、氯化钠由钠离子和氯离子构成,故1mol氯化钠中含1mol钠离子即NA个,故A正确;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,故含质子为9NA个,故B错误;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故分子个数小于2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
8.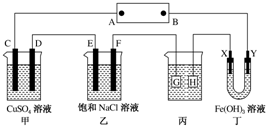 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:1 | |
| C. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 |
9.下列实验设计方案错误的是( )
| A. | 除去Cu(NO3)2溶液中混有的AgNO3:加入适量铜粉 | |
| B. | 分离溴和CCl4的混合物:分液 | |
| C. | 区分NaCl和KCl溶液:焰色反应 | |
| D. | 检验某未知溶液中的SO42-:加入稀硝酸酸化的BaCl2溶液 |
3.下列各组物质混合、加热蒸干、并经充分灼烧,得到混合物的是( )
| A. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合 | |
| B. | 向40mL0.2 mol•L-1的NaOH溶液中通入67.2mLCO2(标况) | |
| C. | 在100mL1 mol•L-1NH4Cl溶液中,投入3.9gNa2O2 | |
| D. | 在20mL0.01 mol•L-1Ma(HCO3)2溶液中,投入0.2g Ma(OH)2 |
2.NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 0.1molC2H6O分子中含有C-H键数为0.5NA | |
| B. | 0.1molCl2和0.1molHI充分反应后气体分子数为0.2NA | |
| C. | CO2通过Na2O2使其增重2.8g,反应中转移电子数为0.2NA | |
| D. | 3.Og甲醛(HCHO)和乙酸的混合物中含有的原子总数为0.4NA |
19.在含有下列离子组的溶液中,加入Fe(NO3)2固体后,仍然能够大量共存的离子组是( )
| A. | K+、SO42-、NH4+、CO32- | B. | K+、Ba2+、OH-、Cl- | ||
| C. | Na+、H+、Cl-、SO42- | D. | Na+、Mg2+、Cl-、NO3- |
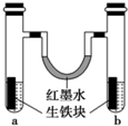 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.