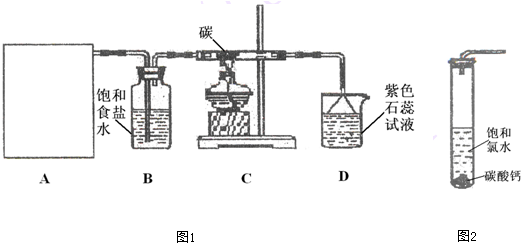
题目内容
硅与金刚砂(SiC)是两种重要的工业产品,它们都可由二氧化硅与碳反应制得.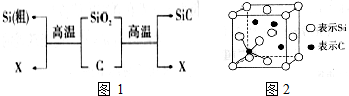
(1)基态Si原子的电子排布式为 ;Si与C相比,电负性较大的是 (填元素符号).
(2)如图1中X可与氧气反应生成Y,Y分子的中心原子杂化轨道类型是 ,键角是 .
(3)由SiO2生成SiC的化学方程式是 .
(4)SiC的一种晶体与晶体硅的结构相似,其中C原子和Si原子的位置是交替的,在SiC中最小的环上有 个原子,SiC与晶体硅相比,SiC熔点较高,原因是 .
(5)SiC晶胞如图2所示,Si-C的键能为a kJ?mol-1,理论上分解l mol SiC形成气态原子所需要的能量为 kJ(用含a的式子表示).

(1)基态Si原子的电子排布式为
(2)如图1中X可与氧气反应生成Y,Y分子的中心原子杂化轨道类型是
(3)由SiO2生成SiC的化学方程式是
(4)SiC的一种晶体与晶体硅的结构相似,其中C原子和Si原子的位置是交替的,在SiC中最小的环上有
(5)SiC晶胞如图2所示,Si-C的键能为a kJ?mol-1,理论上分解l mol SiC形成气态原子所需要的能量为
考点:原子核外电子排布,有关反应热的计算,元素电离能、电负性的含义及应用,晶体的类型与物质熔点、硬度、导电性等的关系,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)根据核外电子排布规则可知Si原子的电子排布式,依据非金属性判断电负性;
(2)依据图示可知X为CO,CO与氧气反应生成二氧化碳,二氧化碳为直线形分子,其中C原子采取sp杂化;
(3)SiO2和焦炭反应生成碳化硅和CO;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子;原子晶体熔沸点的高低取决于共价键的稳定性;
(5)依据晶胞计算方法计算即可.
(2)依据图示可知X为CO,CO与氧气反应生成二氧化碳,二氧化碳为直线形分子,其中C原子采取sp杂化;
(3)SiO2和焦炭反应生成碳化硅和CO;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子;原子晶体熔沸点的高低取决于共价键的稳定性;
(5)依据晶胞计算方法计算即可.
解答:
解:(1)基态Si原子电子排布式为1s22s22p63s23p2,同主族自下而上电负性逐渐增大,因此电负性:C>Si,
故答案为:1s22s22p63s23p2;C;
(2)CO与氧气反应生成二氧化碳,二氧化碳为直线型分子,C原子采取sp杂化方式,故答案为:sp;180°;
(3)SiO2和焦炭反应生成碳化硅和CO,化学方程式为:SiO2+3C
SiC+2CO;故答案为:SiO2+3C
SiC+2CO;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子,两者都是原子晶体,结构和组成相似,Si-Si键长大于Si-C键长,Si-Si键能小,晶体硅的熔沸点低于碳化硅,
故答案为:6;两者都是原子晶体,结构和组成相似,Si-Si键长大于Si-C键长,Si-Si键能小,晶体硅的熔沸点低于碳化硅;
(5)SiC中,C位于顶点和面心,故C为:8×
+6×
=4,Si位于晶胞的中心,故Si为4,那么该晶胞即为Si4C4
,即l mol SiC中含有4mol共价键,故分解l mol SiC形成气态原子所需要的能量为4akJ,故答案为:4a.
故答案为:1s22s22p63s23p2;C;
(2)CO与氧气反应生成二氧化碳,二氧化碳为直线型分子,C原子采取sp杂化方式,故答案为:sp;180°;
(3)SiO2和焦炭反应生成碳化硅和CO,化学方程式为:SiO2+3C
| ||
| ||
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子,两者都是原子晶体,结构和组成相似,Si-Si键长大于Si-C键长,Si-Si键能小,晶体硅的熔沸点低于碳化硅,
故答案为:6;两者都是原子晶体,结构和组成相似,Si-Si键长大于Si-C键长,Si-Si键能小,晶体硅的熔沸点低于碳化硅;
(5)SiC中,C位于顶点和面心,故C为:8×
| 1 |
| 8 |
| 1 |
| 2 |
,即l mol SiC中含有4mol共价键,故分解l mol SiC形成气态原子所需要的能量为4akJ,故答案为:4a.
点评:本题考查化学方程式的书写和物质结构中电子排布图、电负性、化学键、杂化类型、分子结构和空间构型、晶胞计算等知识,综合性强,为物质结构常规考题形式,计算难度较大.

练习册系列答案
相关题目
短周期元素X、Y、Z在周期表中的相对位置如图所示,下列判断正确的是( )
| X | ||
| Y | ||
| Z |
| A、X是最活泼的非金属元素 |
| B、Y的最高化合价为+7 |
| C、Z原子的最外层电子数是6 |
| D、3种元素的单质分子都是双原子分子 |
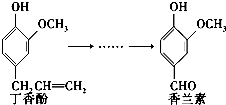 香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )| A、常温下,1 mol丁香酚只能与1 mol Br2反应 |
| B、香兰素分子中至少有12个原子共平面 |
| C、1 mol香兰素最多能与3 mol氢气发生加成反应 |
| D、香兰素和丁香酚都不能与银氨溶液发生反应 |
下列措施中肯定能使化学反应速率增大的是( )
| A、增大反应物的量 | B、增大压强 |
| C、降低温度 | D、升高温度 |
下列反应的离子方程式正确的是( )
| A、S02气体通入新制氯水中:SO2+2HC1O=2C1-+SO42-+2H+ |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、向NaA102溶液中通入少量CO2:2A1O2-+CO2+3H2O=2A1(OH)3↓+CO32- |
| D、澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
100mL 1mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
①醋酸钠(固体) ②水 ③硫酸钾溶液 ④硫酸铵(固体)⑤100mL 2mol/L硫酸氢铵溶液 ⑥将1mol/L硫酸改为18mol/L硫酸 ⑦硝酸钾溶液⑧将锌粉改为锌块.
①醋酸钠(固体) ②水 ③硫酸钾溶液 ④硫酸铵(固体)⑤100mL 2mol/L硫酸氢铵溶液 ⑥将1mol/L硫酸改为18mol/L硫酸 ⑦硝酸钾溶液⑧将锌粉改为锌块.
| A、①③④⑥ | B、④⑤⑥⑦ |
| C、①②③⑧ | D、③④⑤⑦ |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、KCl晶体、BaC03 |
| B、铁、二氧化硫 |
| C、液态的醋酸、乙醇 |
| D、熔融的K2SO4、盐酸溶液 |
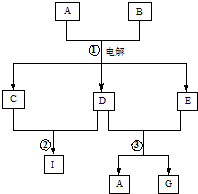 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)