题目内容
14.淡黄色粉末A跟无色液体B反应有无色气体C产生,金属D在C中燃烧可生成A,D跟B反应放出气体E,E和C又化合为B.从以上实验现象可判断:(1)则A的化学式为Na2O2;
(2)A与B反应的离子方程式为2H2O+2Na2O2=4Na++4OH-+O2↑;
(3)属于D在C中燃烧的现象的是(填序号)①②③④.
①A先熔化成闪亮的小球 ②剧烈燃烧 ③产生黄色火焰 ④生成淡黄色固体.
分析 浅黄色粉末A跟无色液体B反应有无色气体C产生,金属D在C中燃烧可生成A,D跟B反应放出气体E,E和C又化合为B,结合钠及其化合物性质可知:A为Na2O2,B为H2O,C为O2,D为Na,E为H2,氢气与氧气反应得到水,过氧化钠与水反应生成氢氧化钠与氧气,氧气与钠点燃反应生成过氧化钠,钠与水反应生成氢氧化钠和氢气,氢气与氧气反应生成水.
解答 解:(1)则A的化学式为Na2O2,故答案为:Na2O2;
(2)A与B反应生成过氧化钠与水反应生成氢氧化化钠和氧气,离子方程式为2H2O+2Na2O2=4Na++4OH-+O2↑,故答案为:2H2O+2Na2O2=4Na++4OH-+O2↑;
(3)属于D在C中燃烧,反应的化学方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,钠的熔点低,钠是活泼的金属,产生黄色火焰 同时生成淡黄色固体过氧化钠,故选:①②③④.
点评 本题为无机推断题,考查了钠及其化合物性质及相互之间的转化,解题突破口为浅黄色粉末A,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
4.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.
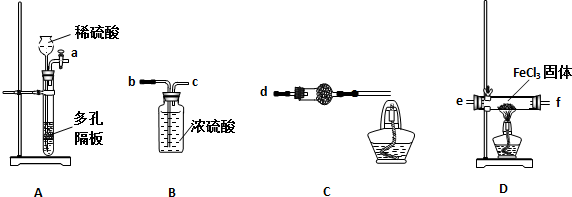
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置C中酒精灯的作用是:燃烧H2,防止污染空气
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
②样品中氯化亚铁的质量分数为70.1%.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置C中酒精灯的作用是:燃烧H2,防止污染空气
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为70.1%.
9.聚合氯化铝(PAC)通式为[Al2(OH)nCl6-n]m,是无机高分子混凝剂,它是用软铝矿(主要成分Al2O3•H2O)为原料制备,制备的最后一步反应是将Al(OH)3凝胶与[Al(OH)2(H2O)4]Cl按照一定配比恰好完全反应制得PAC,则该反应中前者与后者的物质的量之比为( )
| A. | 1:1 | B. | $\frac{4-n}{6-n}$ | C. | $\frac{n-4}{6-n}$ | D. | $\frac{1}{m}$ |
19.下列不含有共价键的化合物是( )
| A. | CaCl2 | B. | NaOH | C. | NH4Cl | D. | H2O |
 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池, 某化学小组设计如图装置完成一组实验;
某化学小组设计如图装置完成一组实验;