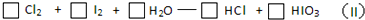题目内容
A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18.A元素原子核外只有1个电子;C是地壳中含量最多的元素;B、C可形成两种化合物BC和BC2,B的最高正价与最低负价绝对值相等,BC有毒,BC2可用于灭火;D元素的最外层电子数是其电子层数的三分之一;E-具有与Ar原子相同的电子层结构.
(1)写出A、C两种元素的符号:A ,C .
(2)写出D原子和E-离子的结构示意图:D原子 ,E-离子 .
(3)由A、B、C、D四种元素组成的常见化合物的化学式为 ,其电离方程式为 .
(4)写出A、C、D三种元素组成的常见化合物的稀溶液,常温下和E的单质反应的化学方程式 .
(1)写出A、C两种元素的符号:A
(2)写出D原子和E-离子的结构示意图:D原子
(3)由A、B、C、D四种元素组成的常见化合物的化学式为
(4)写出A、C、D三种元素组成的常见化合物的稀溶液,常温下和E的单质反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18.A元素原子核外只有1个电子,则A为H元素;C是地壳中含量最多的元素,则C为O元素;B、C可形成两种化合物BC和BC2,B的最高正价与最低负价绝对值相等,应处于ⅣA族,BC有毒,BC2可用于灭火,则B为碳元素;D元素的最外层电子数是其电子层数的三分之一,只能处于第三周期,最外层电子数为1,则D为Na;E-具有与Ar原子相同的电子层结构,E原子质子数=18-1=17,则E为Cl元素,据此解答.
解答:
解:A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18.A元素原子核外只有1个电子,则A为H元素;C是地壳中含量最多的元素,则C为O元素;B、C可形成两种化合物BC和BC2,B的最高正价与最低负价绝对值相等,应处于ⅣA族,BC有毒,BC2可用于灭火,则B为碳元素;D元素的最外层电子数是其电子层数的三分之一,只能处于第三周期,最外层电子数为1,则D为Na;E-具有与Ar原子相同的电子层结构,E原子质子数=18-1=17,则E为Cl元素,
(1)由上述分析可知,A、C的元素符号分别为:H、O,故答案为:H;O;
(2)D为Na,其原子结构示意图为 ,Cl-离子结构示意图为:
,Cl-离子结构示意图为: ,
,
故答案为: ;
; ;
;
(3)由H、C、O、Na四种元素组成的常见化合物为 NaHCO3,电离方程式为:NaHCO3=Na++HCO3-,
故答案为:NaHCO3;NaHCO3=Na++HCO3-;
(4)H、O、Na三种元素组成的常见化合物为NaOH,常温下氢氧化钠稀溶液与氯气反应生成氯化钠、次氯酸钠与水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
(1)由上述分析可知,A、C的元素符号分别为:H、O,故答案为:H;O;
(2)D为Na,其原子结构示意图为
 ,Cl-离子结构示意图为:
,Cl-离子结构示意图为: ,
,故答案为:
 ;
; ;
;(3)由H、C、O、Na四种元素组成的常见化合物为 NaHCO3,电离方程式为:NaHCO3=Na++HCO3-,
故答案为:NaHCO3;NaHCO3=Na++HCO3-;
(4)H、O、Na三种元素组成的常见化合物为NaOH,常温下氢氧化钠稀溶液与氯气反应生成氯化钠、次氯酸钠与水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
在2NO2?N2O4的可逆反应中,下列状态属于平衡状态的是( )
| A、υ正=υ逆≠0时的状态 |
| B、NO2全部转变成N2O4的状态 |
| C、c(NO2)=c(N2O4)的状态 |
| D、N2O4不再分解的状态 |
下列说法错误的是( )
| A、0.012kg 12C含有的12C是NA个 |
| B、NA个水分子的质量是18g/mol |
| C、1mol O2中含有的氧气分子数为NA个 |
| D、含有NA个氧原子的H2SO4的物质的量是0.25mol |