题目内容
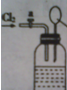 向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:(1)写出该实验现象
(2)反应后集气瓶的主要成分是
(3)反应涉及的化学方程式是
考点:甲烷的化学性质,取代反应与加成反应
专题:有机反应
分析:甲烷和氯气在光照条件下发生取代反应生成甲烷的氯代物和氯化氢,氯化氢易溶于水,和硝酸银反应生成氯化银沉淀,甲烷的氯代物中一氯甲烷为气体,其余为液体,据此分析现象和集气瓶中的成分及反应方程式的书写.
解答:
解:(1)甲烷和氯气在光照条件下发生取代反应生成甲烷的氯代物和氯化氢,氯化氢易溶于水,和硝酸银反应生成氯化银沉淀,甲烷的氯代物中一氯甲烷为气体,其余为油状液体.故该实验现象为:集气瓶中出现白色沉淀,气球变小,集气瓶上方有黄绿色气体,瓶壁有油状物质;
故答案为:集气瓶中出现白色沉淀,气球变小,集气瓶上方有黄绿色气体,瓶壁有油状物质;
(2)根据以上分析,集气瓶的主要成分为未发应的甲烷和氯气,及反应生成的一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷及氯化氢;
故答案为:甲烷、氯气、一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷;
(3)反应涉及方程式为:CH4+Cl2
CH3Cl+HCl、CH3Cl+Cl2
CH2Cl2+HCl、CH2Cl2+Cl2
CHCl3+HCl、CHCl3+Cl2
CCl4+HCl、HCl+AgNO3═AgCl↓+HNO3;故答案为:CH4+Cl2
CH3Cl+HCl、CH3Cl+Cl2
CH2Cl2+HCl、CH2Cl2+Cl2
CHCl3+HCl、CHCl3+Cl2
CCl4+HCl、HCl+AgNO3═AgCl↓+HNO3.
故答案为:集气瓶中出现白色沉淀,气球变小,集气瓶上方有黄绿色气体,瓶壁有油状物质;
(2)根据以上分析,集气瓶的主要成分为未发应的甲烷和氯气,及反应生成的一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷及氯化氢;
故答案为:甲烷、氯气、一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷;
(3)反应涉及方程式为:CH4+Cl2
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
点评:本题考查了甲烷的性质,注意甲烷和氯气发生取代生成一系列取代产物,本题写方程式,可只写生成一氯甲烷的方程式,其余氯代物的反应方程式可不写.

练习册系列答案
相关题目
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.