题目内容
11.下列物质在生活中应用时,起氧化作用的是( )| A. | 氢氟酸在玻璃器皿上刻蚀标记 | B. | 液氨用作制冷剂 | ||
| C. | 铁粉作食品袋内的脱氧剂 | D. | 漂粉精作消毒剂 |
分析 含元素化合价变化的反应为氧化还原反应,若含元素的化合价降低,作氧化剂,则起氧化作用,以此来解答.
解答 解:A.氢氟酸在玻璃器皿上刻蚀标记,HF与二氧化硅发生复分解反应,不存在化合价的变化,不是氧化还原反应,故A不选;
B.液氨用作制冷剂,利用了物理性质,故B不选;
C.铁粉作食品袋内的脱氧剂,利用Fe的还原性,起还原作用,故C不选;
D.漂粉精作消毒剂,利用其氧化性,使细菌、病毒的蛋白质发生变性,故D选;
故选D.
点评 本题考查氧化还原反应,把握反应中物质的性质及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
2.下列化学用语正确的是( )
①羟基的电子式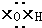 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2
③甲烷的结构式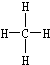 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4
⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
①羟基的电子式
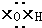 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2③甲烷的结构式
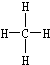 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
| A. | ①④ | B. | ②④⑥ | C. | ②③ | D. | ②③⑤ |
6.下列反应属于吸热反应的是( )
| A. | 稀硫酸与氢氧化钾溶液反应 | B. | 食物腐败 | ||
| C. | 锌与稀硫酸的反应 | D. | 氢氧化钡晶体与氯化铵晶体反应 |
16.已知酸性条件下有如下反应:2Cu+═Cu2++Cu.由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
由此推出本次氢气还原氧化铜实验的产物是( )
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
3.某元素X的核外电子数等于核内中子数,取该元素单质2.8克与氧充分作用,可得到6克化合物XO2.下列说法正确的是( )
| A. | 该元素位于第2周期 | |
| B. | 该元素位于第VI A族 | |
| C. | 该元素的氢化物溶于水显碱性 | |
| D. | 该元素最高价氧化物的水化物是一种弱酸 |
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质.请回答下列问题:
 ;
; ;
; ;
; (写出一种即可).
(写出一种即可).