题目内容
 (1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:
(1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:①达平衡时混合气体的体积为
②若起始时加入amolSO2、bmolO2,且a:b=2:1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L.则a、b的值分别为:a
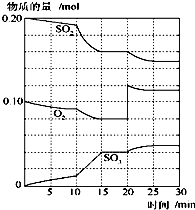
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因是
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量.
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)①根据V=
计算体积,根据反应方程式为2SO2+O2?2SO3,利用三段式计算转化率;
②根据①、②平衡状态相同计算;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大;由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.据此结合选项分析.
| m |
| ρ |
②根据①、②平衡状态相同计算;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大;由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.据此结合选项分析.
解答:
解:(1)①在反应2SO2+O2?2SO3中,质量守恒,所以V=
=
L=80L;
2SO2+O2?2SO3
起始:2mol 1mol 0
转化:2x x 2x
平衡:1.6-2x 0.8-x 2x
根据体积之比等于物质的量之比可知:(1.6-2x+0.8-x+2x):2.4=80:100,
解之得x=0.48,反应的气体的物质的量为:1.6-0.48×2+0.8-0.48+0.48×2=1.92mol,
所以SO2的转化率为
×100%=60%,
故答案为:80L;60%;
②起始时加入amolS02、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,与(1)平衡状态相同,为等效平衡,物质的转化率和百分含量都相同,SO3的体积分数为与①相同,
2SO2 +O2 ?2SO3
起始:amol bmol 0
转化:0.6a 0.3a 0.6a
平衡:a-0.6a b-0.3a 0.6a
压强之比就等于物质的量之比,列式为:
=
,a=2b,
解得:a=2.4mol,b=1.2mol,
故答案为:2.4;1.2;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min和25~30 min;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
A.加了催化剂,增大反应速率,故A正确;
B.缩小容器体积,增大压强,增大反应速率,故B正确;
C.降低温度反应速率降低,故C错误;
D.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故D错误.
故选:AB;
故答案为:增大了氧气的浓度;AB.
| m |
| ρ |
| 1.6×64+0.8×32 |
| 1.6 |
2SO2+O2?2SO3
起始:2mol 1mol 0
转化:2x x 2x
平衡:1.6-2x 0.8-x 2x
根据体积之比等于物质的量之比可知:(1.6-2x+0.8-x+2x):2.4=80:100,
解之得x=0.48,反应的气体的物质的量为:1.6-0.48×2+0.8-0.48+0.48×2=1.92mol,
所以SO2的转化率为
| 0.48×2 |
| 1.6 |
故答案为:80L;60%;
②起始时加入amolS02、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,与(1)平衡状态相同,为等效平衡,物质的转化率和百分含量都相同,SO3的体积分数为与①相同,
2SO2 +O2 ?2SO3
起始:amol bmol 0
转化:0.6a 0.3a 0.6a
平衡:a-0.6a b-0.3a 0.6a
压强之比就等于物质的量之比,列式为:
| a-0.6a+b-0.3a+0.6a |
| 1.92 |
| 120 |
| 80 |
解得:a=2.4mol,b=1.2mol,
故答案为:2.4;1.2;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min和25~30 min;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
A.加了催化剂,增大反应速率,故A正确;
B.缩小容器体积,增大压强,增大反应速率,故B正确;
C.降低温度反应速率降低,故C错误;
D.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故D错误.
故选:AB;
故答案为:增大了氧气的浓度;AB.
点评:本题考查化学平衡和等效平衡问题,题目难度较大,注意等效平衡状态的理解和运用.

练习册系列答案
相关题目
下列各项表达中正确的( )
A、N2的电子式: | ||
| B、106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况) | ||
C、邻羟基苯甲酸的结构简式: | ||
D、质子数为53,中子数为78的碘原子:
|
将浓度为A%的NaOH溶液蒸发w g水后,成为V mL的2A%的NaOH溶液,则蒸发后的溶液其物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列金属中,在冷的浓硝酸中最难溶解的是( )
| A、铜 | B、银 | C、铝 | D、镁 |

 (1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=