题目内容
亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4═Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是 ,若反应中有5mol电子转移,则生成碘是 mol.
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)②IO2-+SO32-→IO-+SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)④I2+SO32-+H2O→2I-+SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由 步反应决定.
(1)其中氧化剂是
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)②IO2-+SO32-→IO-+SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)④I2+SO32-+H2O→2I-+SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由
考点:氧化还原反应
专题:氧化还原反应专题
分析:Na2SO3+KIO3+H2SO4═Na2SO4+K2SO4+I2+H2O中,S元素的化合价升高,I元素的化合价降低,结合慢反应决定反应速率来解答.
解答:
解:(1)I元素的化合价降低,则KIO3为氧化剂,I元素的化合价由+5价降低为0,则有5mol电子转移,则生成碘是
=0.5mol,故答案为:KIO3;0.5;
(2)慢反应决定反应速率,则此反应的总的反应速率由①步反应决定,故答案为:①.
| 5mol |
| 2×(5-0) |
(2)慢反应决定反应速率,则此反应的总的反应速率由①步反应决定,故答案为:①.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子组能大量共存的是( )
| A、含有大量NH4+的溶液中:HCO3-、K+、Na+、Cl- |
| B、酚酞呈红色的溶液中:Na+、AlO2-、K+、HCO3- |
| C、含大量H+的溶液中:Na+、Cl-、NO3-、SO32- |
| D、加入Fe能放出H2的溶液中:Na+、K+、NO3-、SO42- |
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol.若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 mol.
(2)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 mol/L.
(1)该气体的物质的量为
(2)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
0.8g物质含有3.01×1022个分子,则1mol该物质的质量是( )
| A、8g | B、19g |
| C、64g | D、16g |
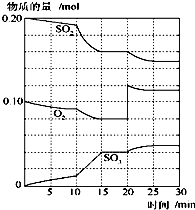 (1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:
(1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题: