题目内容
6.下列物质中含有Cl-的是( )| A. | 液态氯化氢 | B. | 次氯酸钠溶液 | C. | 固体氯化钠 | D. | 四氯化碳 |
分析 HCl溶于水发生电离产生Cl-,盐酸盐含Cl-,盐酸盐在熔融状态或溶于水发生电离产生自由移动Cl-,以此来解答.
解答 解:A.液态氯化氢由分子构成,不含离子,故A不选;
B.次氯酸钠溶液中电离产生ClO-,故B不选;
C.固体氯化钠由离子构成,含Cl-,故C选;
D.四氯化碳由分子构成,不含离子,故D不选;
故选C.
点评 本题考查含氯物质的构成,为高频考点,把握物质的组成、构成为解答的关键,侧重分析与应用能力的考查,注意由分子构成的物质,题目难度不大.

练习册系列答案
相关题目
19.分子式为C5H12O的醇,催化氧化后能生成的醛有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
16.下列说法正确的是( )
| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 提纯含细沙的苯甲酸的方法是重结晶,具体操作是:溶解,加热浓缩,冷却结晶,过滤,洗涤 | |
| C. | 开始蒸馏时,应先加热再通冷凝水,停止蒸馏时应先熄灭酒精灯最后停止通冷凝水 | |
| D. | 石蜡油的分解实验中,碎瓷片的作用是积蓄热量和作催化剂 |
11.已知25℃时草酸的电离常数为K1=5.00×10-2,K2=5.40×10-5,草酸钙的Ksp=4.00×10-8,碳酸钙的Ksp=2.50×10-9.不同温度下水的离子积常数见下表:
(1)草酸在水溶液中所有的电离反应方程式H2C2O4?HC2O4-+H+,HC2O4-?C2O42-+H+;
计算25℃时KHC2O4溶液的水解平衡常数Kh=2.0×10-13;
(2)常温下将0.2mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中各离子的浓度由大到小顺序为c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(3)90℃时,将0.005mol/L的Ba(OH)2溶液20mL与0.0024mol/L的HCl溶液20mL混合,混合后溶液的pH=10;
(4)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10-4mol/L的草酸钾溶液10mL,不能(填“能”或“不能”)产生沉淀.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.58 | 38.0 | 55.0 |
计算25℃时KHC2O4溶液的水解平衡常数Kh=2.0×10-13;
(2)常温下将0.2mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中各离子的浓度由大到小顺序为c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(3)90℃时,将0.005mol/L的Ba(OH)2溶液20mL与0.0024mol/L的HCl溶液20mL混合,混合后溶液的pH=10;
(4)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10-4mol/L的草酸钾溶液10mL,不能(填“能”或“不能”)产生沉淀.
18.下列有关高分子化合物的说法不正确的是( )
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料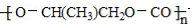 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
15.下列各组中的物质均能发生加成反应的是( )
| A. | 甲烷和乙醇 | B. | 丙烯和丙烷 | C. | 乙酸和乙酸乙酯 | D. | 苯和乙烯 |
16.有机物A经氧化后得B(化学式为C2H3O2Br),而A经水解得D,1molD和2molB反应得到一种含溴的酯(C6H8O4Br2).由此推断A的结构简式为( )
| A. | Br-CH2CH2OH | B. |  | C. |  | D. | HOCH2CH2OH |

 .
. .
. .
. ;
;