题目内容
13.下列顺序不正确的是( )| A. | 分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 碱性 Mg(OH)2<NaOH<KOH | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | Cl和Br属于ⅦA族元素,两原子核外电子数之差为8 |
分析 A、分散质微粒直径:悬浊液>胶体>溶液;
B、元素的金属性越强,最高价氧化物的水化物的碱性越强;
C、同周期元素从左到右元素的非金属性逐渐增强;
D、Cl和Br原子序数相差18.
解答 解:A、分散质微粒直径:悬浊液>胶体>溶液,故Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故A正确;
B、金属性:Mg<Na<K,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,所以碱性:Mg(OH)2<NaOH<KOH,故B正确;
C、同周期元素从左到右元素的非金属性逐渐增强,即ⅦA族元素是同周期中非金属性最强的元素,故C正确;
D、Cl和Br原子序数相差18,而不是8,故D错误;
故选D.
点评 本题考查学生元素周期表的应用以及原子结构知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
3.下列有关阿佛加德罗常数(NA)的说法错误的是( )
| A. | 0.5mol H2O含有的原子数目为1.5NA | |
| B. | 32g O2所含的原子数目为NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
4.下列有关实验的操作不正确的是( )
| A. | 分液时,分液漏斗内的上层液体应由上口倒出 | |
| B. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制0.1mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,加热,用湿润蓝色石蕊试纸检验逸出的气体 |
1.下列说法不正确的是( )
| A. | 干冰可用于人工降雨 | |
| B. | 过氧化钠常用作航天员的供氧剂 | |
| C. | 乘车严禁携带易燃、易爆等危险品 | |
| D. | 大量开采、使用可燃冰不会对环境造成影响 |
19.下列叙述中,正确的是( )
| A. | 氧化还原反应的实质是化合价变化 | |
| B. | 具有氧化性的物质在反应中一定做氧化剂 | |
| C. | 氧化剂氧化其他物质时,本身被还原 | |
| D. | 还原剂在反应中本身被还原 |
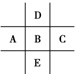 图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )
图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )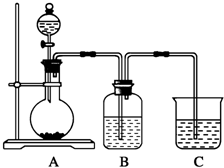 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.