题目内容
9. C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.
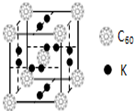
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.(1)科学家把C60和钾掺杂在一起制造了一种富勒烯 化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30
(3)写试出C60、Si60、N60熔点由高到低的顺序为Si60>N60>C60,破坏这三种分子所需要的能量顺序为N60>C60>Si60.
分析 (1)利用均摊法确定K原子和C60分子的个数比;
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以硅原子周围有一个双键和两个单键,双键中有一个π键,每个硅原子只占有$\frac{1}{2}$个π键;
(3)结构相似的分子晶体熔点与其相对分子质量成正比,破坏分子需要断开化学键,元素的化学键的稳定性与元素的电负性成正比
解答 解:(1)根据均摊法可知,该晶胞中C60个数=1+8×$\frac{1}{8}$=2,6×2×$\frac{1}{2}$=6,所以K原子和C60分子的个数比为6:2=3:1,故答案为:3:1;
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以硅原子周围有一个双键和两个单键,双键中有一个π键,每个硅原子只占有$\frac{1}{2}$个π键,所以Si60分子中π键的数目为60×$\frac{1}{2}$=30,
故答案为:30;
(3)Si60、N60、C60都是结构相似的分子晶体,分子晶体的熔点与其相对分子质量成正比,相对分子质量越大,分子间作用力越强,熔化所需能量越多,所以熔点Si60>N60>C60,破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多,所以破坏分子需要的能量顺序为:N60>C60>Si60,
故答案为:Si60>N60>C60;N60>C60>Si60.
点评 本题考查核外电子排布式的书写、氢键、化学式的确定等知识点,明确影响分子晶体中熔点、化学键大小的因素,为学习难点.

练习册系列答案
相关题目
19.分子式为C5H10O2,属于酯类的同分异构体有多少种( )
| A. | 9种 | B. | 13种 | C. | 10种 | D. | 11种 |
20.下列过程中,有电能转化为化学能的是( )
| A. | 打手机 | B. | 光合作用 | C. | 电解水 | D. | 点燃氢气 |
4. 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )| A. | 任何分子式中的“•”都表示氢键 | |
| B. | H2O2是极性分子,其结构简式为HO-OH | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | H2NCONH2与H2O2是通过氢键结合的 |
14. (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
复分解反应存在这样一个规律:一种较强酸(或碱性较强的物质)可以自发地反应生成较弱酸(或碱性较弱的物质).照该规律,请判断下列反应不能成立的是CD (填编号).
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前述信息判断,浓度均为0.05mol•L-1的下列六种物质的溶液中,pH最小的是⑤ (填编号);将各溶液分别稀释100倍,pH变化最小的是① (填编号).
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前述信息判断,浓度均为0.05mol•L-1的下列六种物质的溶液中,pH最小的是⑤ (填编号);将各溶液分别稀释100倍,pH变化最小的是① (填编号).
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
1.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 丙烷分子的球棍模型为: | ||
| C. | 四氯化碳分子的电子式为: | D. |  的分子式是:C6H12O 的分子式是:C6H12O |
18.下列说法中正确的是( )
| A. | 二次电池在充电时,电池的负极要与外接电源的负极相连 | |
| B. | 用惰性电极电解硫酸铜溶液一段时间后,加入氢氧化铜可恢复原状 | |
| C. | 化学腐蚀是生活中最常见的一种金属腐蚀 | |
| D. | 燃料电池中的电极材料必须活性不同 |
10. 己二酸
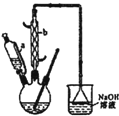
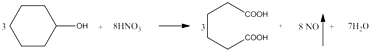
己二酸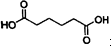 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
可能用到的有关数据如下:
实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.
Ⅴ、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)滴液漏斗的细支管a的作用是平衡滴液漏斗与三颈瓶内的压强,使环己醇能够顺利流,仪器b的名称为球形冷凝管.
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O
NO+NO2+2NaOH=2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2、NO+NO2+Na2CO3═2NaNO2+CO2;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中(任写一个).
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
 己二酸
己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
可能用到的有关数据如下:
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.360/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 | 146 |
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.
Ⅴ、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)滴液漏斗的细支管a的作用是平衡滴液漏斗与三颈瓶内的压强,使环己醇能够顺利流,仪器b的名称为球形冷凝管.
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O
NO+NO2+2NaOH=2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2、NO+NO2+Na2CO3═2NaNO2+CO2;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中(任写一个).
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
 化学在能源开发与利用中起着十分重要的作用.
化学在能源开发与利用中起着十分重要的作用.