题目内容
1.下列化学用语正确的是( )| A. | 聚丙烯的结构简式为: | B. | 丙烷分子的球棍模型为: | ||
| C. | 四氯化碳分子的电子式为: | D. |  的分子式是:C6H12O 的分子式是:C6H12O |
分析 A、聚丙烯的链节的主链上只含有2个碳原子;
B、丙烷为饱和烷烃,存在碳碳单键和碳氢单键,三个碳原子在一条链上;
C、氯原子未成键的孤对电子对未标出;
D、键线式中的端点和拐点均为碳原子,每个碳原子形成4条价键,据此分析.
解答 解:A、聚丙烯为丙烯加聚反应产物,其链节的主链上含有2个碳原子,聚丙烯正确的结构简式为: ,故A错误;
,故A错误;
B、丙烷为饱和烷烃,存在碳碳单键和碳氢单键,三个碳原子在一条链上,球棍模型为: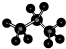 ,故B正确;
,故B正确;
C、氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故C错误;
,故C错误;
D、键线式中的端点和拐点均为碳原子,每个碳原子形成4条价键,故此有机物中碳原子为7个,氢原子为12个,一个O原子,故分子式为C7H12O,故D错误.
故选B.
点评 本题考查了常见的化学用语,难度不大,注意四氯化碳和甲烷电子式书写的区别以及聚丙烯的结构简式的书写.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
12.某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的量对氢气生成速率的影响,该小组同学开始了实验探究.
(1)实验方案:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的锥形瓶中,收集产生的气体.记录单位时间氢气产生的体积.
其中:V1=30,V6=10,V9=17.5;
(2)实验装置:甲同学拟选用图1实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接E接D接G(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶.请你帮助分析原因锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大.
③实验最后,在读取测量实验中生成氢气的总体积时,你认为合理的是ACD.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
④乙同学认为可选用图2装置中的B(填A或B)直接与锥形瓶的导管A相连用以测量氢气的体积,理由是防止气体冷却时发生倒吸现象;实验结束时量筒内的液面高于水槽中液面,立即读数会使氢气的总体积偏大(填“偏大”“偏小”或“不变”);应进行的操作是应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平;
(3)实验现象与结论:反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;该学习小组最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(4)问题讨论:实验室中现有Na2SO4、MgSO4、AgSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(1)实验方案:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的锥形瓶中,收集产生的气体.记录单位时间氢气产生的体积.
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(2)实验装置:甲同学拟选用图1实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接E接D接G(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶.请你帮助分析原因锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大.
③实验最后,在读取测量实验中生成氢气的总体积时,你认为合理的是ACD.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
④乙同学认为可选用图2装置中的B(填A或B)直接与锥形瓶的导管A相连用以测量氢气的体积,理由是防止气体冷却时发生倒吸现象;实验结束时量筒内的液面高于水槽中液面,立即读数会使氢气的总体积偏大(填“偏大”“偏小”或“不变”);应进行的操作是应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平;
(3)实验现象与结论:反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;该学习小组最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(4)问题讨论:实验室中现有Na2SO4、MgSO4、AgSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
6.下列化合物中,在常温常压下以液态形式存在的是( )
| A. | 丙三醇 | B. | 乙炔 | C. | 丙烯 | D. | 丁烷 |
13.下列分子中,中心原子是sp1杂化的是( )
| A. | BeCl2 | B. | H2O | C. | CH4 | D. | BF3 |
10.在100mL浓度为18mol/L、密度为ρg/mL的浓硫酸中,加入一定量的水,稀释成9mol/L的硫酸,则加入水的体积为( )
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{ρ}$mL |
2.下列关于化学反应的说法错误的是( )


| A. | 化学反应中有物质变化也有能量变化 | |
| B. | 需要加热的化学反应不一定是吸热反应 | |
| C. | 如图所示的反应为放热反应 | |
| D. | 化学反应中的热量变化取决于反应物的能量和生成物的能量的相对高低 |
 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.