题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
①写出由A、B两元素形成的原子个数比为1:1的化合物的化学式为 ,此化合物能使酸性KMnO4溶液退色,体现该化合物具有 性.
②D元素在元素周期表中的位置为 ,B和C两元素形成的原子个数比为1:1的化合物中含有的化学键的类型为 .
③A、B、C、D四种原子半径由大到小为 (填元素符号);四种离子半径由大到小为 (填离子符号).
①写出由A、B两元素形成的原子个数比为1:1的化合物的化学式为
②D元素在元素周期表中的位置为
③A、B、C、D四种原子半径由大到小为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是原子序数依次增大的短周期元素,A、C及B、D分别是同一主族元素,确定B、D分别位于二、三周期;由于B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,确定A、C分别位于一、三周期,所以A为氢、C为钠,B、D的质子数之和为24,则B为氧、D为硫,四种元素形成的单质中有两种是气体为氢气和氧气,两种是固体金属钠和硫单质,据此解答即可.
解答:
解:依据分析可知:A为H,B为O,C为Na,D为S;
①由H、O两元素形成的原子个数比为1:1的化合物为双氧水,双氧水的化学式为:H2O2,双氧水具有还原性,能使高锰酸钾溶液褪色,故答案为:H2O2,还原;
②S元素在元素周期表中的位置为第三周期第Ⅵ族,O和Na两元素形成的原子个数比为1:1的化合物为过氧化钠,其中钠离子与过氧根离子形成离子键,过氧根中两个氧形成非极性共价键,故答案为:第三周期第Ⅵ族;离子键、非极性共价键;
③H、O、Na、S四种原子,同一周期原子序数小的半径大,周期数大的比周期数小的半径大,故四种原子半径由大到小为Na>S>O>H,四种离子半径:最外层电子排布相同时,原子序数越小,半径越大,电子层数越多,半径越多,故四种离子半径由大到小为:S2->O2->Na+>H+,故答案为:Na>S>O>H;S2->O2->Na+>H+.
①由H、O两元素形成的原子个数比为1:1的化合物为双氧水,双氧水的化学式为:H2O2,双氧水具有还原性,能使高锰酸钾溶液褪色,故答案为:H2O2,还原;
②S元素在元素周期表中的位置为第三周期第Ⅵ族,O和Na两元素形成的原子个数比为1:1的化合物为过氧化钠,其中钠离子与过氧根离子形成离子键,过氧根中两个氧形成非极性共价键,故答案为:第三周期第Ⅵ族;离子键、非极性共价键;
③H、O、Na、S四种原子,同一周期原子序数小的半径大,周期数大的比周期数小的半径大,故四种原子半径由大到小为Na>S>O>H,四种离子半径:最外层电子排布相同时,原子序数越小,半径越大,电子层数越多,半径越多,故四种离子半径由大到小为:S2->O2->Na+>H+,故答案为:Na>S>O>H;S2->O2->Na+>H+.
点评:本题考查结构性质位置关系、常用化学用语、半径大小比较等,难度中等,推断元素是解题关键,注意基础知识的理解掌握.

练习册系列答案
相关题目
在苯和苯酚组成的混合物中,碳元素的质量分数为90% 则混合物中氧元素的质量分数为( )
| A、2.5% | B、5% |
| C、6.5% | D、7.5% |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
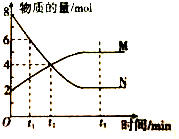

| A、反应的化学方程式:2N?M |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、反应开始时只投入了N |
下列操作使所配溶液的物质的量浓度偏高的是( )
| A、往容量瓶中转移溶液时有少量液体溅出 |
| B、洗净的容量瓶未干燥立即用来配制溶液 |
| C、定容时俯视刻度线 |
| D、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
下列说法中正确的是( )
| A、有阴离子的晶体一定有阳离子,有阳离子的晶体也一定有阴离子 |
| B、只含有非极性键的分子一定是非极性分子,只含有极性键的分子也一定是极性分子 |
| C、离子化合物中可能存在共价键,共价化合物中也可能存在离子键 |
| D、范德华力属于分子间作用力,但氢键不一定属于分子间作用力 |
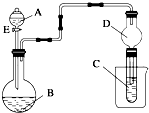 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题: