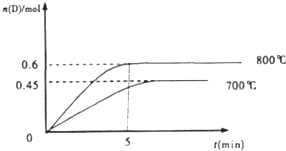
题目内容
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或五种.先进行以下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层清液为无色.
(2)向(1)的悬浊液中加入足量稀硝酸,白色沉淀消失,并有气泡产生.
(3)取少量(1)中的清液滴入Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解.
根据上述实验现象判断:该白色固体中一定含有 ,一定不含有 ,可能含有 .上述实验中有关反应的离子方程式为: 、 .
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层清液为无色.
(2)向(1)的悬浊液中加入足量稀硝酸,白色沉淀消失,并有气泡产生.
(3)取少量(1)中的清液滴入Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解.
根据上述实验现象判断:该白色固体中一定含有
考点:几组未知物的检验
专题:
分析:(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液,一定不含CuSO4;含有CaCO3或是BaCl2、Na2SO4都有中的一种情况;
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生,则沉淀是CaCO3,一定含CaCO3,
(3)取少量(1)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶,沉淀是硫酸钡,一定含有Na2SO4,一定不含BaCl2,据此来回答.
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生,则沉淀是CaCO3,一定含CaCO3,
(3)取少量(1)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶,沉淀是硫酸钡,一定含有Na2SO4,一定不含BaCl2,据此来回答.
解答:
解:(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液,一定不含CuSO4;含有CaCO3或是BaCl2、Na2SO4都有中的一种情况;
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,则沉淀是CaCO3,一定含CaCO3,
(3)取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶,沉淀是硫酸钡,一定含有Na2SO4,一定不含BaCl2.
综上分析可知:一定含有CaCO3、Na2SO4;一定不含有CuSO4、BaCl2;可能含有KNO3,
(2)中发生反应:CaCO3+2H+=Ca2++CO2↑+H2O,(3)中发生:Ba2++SO42-=BaSO4↓,
故答案为:CaCO3、Na2SO4;CuSO4、BaCl2;KNO3;CaCO3+2H+=Ca2++CO2↑+H2O;Ba2++SO42-=BaSO4↓.
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,则沉淀是CaCO3,一定含CaCO3,
(3)取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶,沉淀是硫酸钡,一定含有Na2SO4,一定不含BaCl2.
综上分析可知:一定含有CaCO3、Na2SO4;一定不含有CuSO4、BaCl2;可能含有KNO3,
(2)中发生反应:CaCO3+2H+=Ca2++CO2↑+H2O,(3)中发生:Ba2++SO42-=BaSO4↓,
故答案为:CaCO3、Na2SO4;CuSO4、BaCl2;KNO3;CaCO3+2H+=Ca2++CO2↑+H2O;Ba2++SO42-=BaSO4↓.
点评:本题考查了离子的性质应用,离子检验的现象和判断,关键是判断存在物质,来确定与它不共存的物质.

练习册系列答案
相关题目
下列操作使所配溶液的物质的量浓度偏高的是( )
| A、往容量瓶中转移溶液时有少量液体溅出 |
| B、洗净的容量瓶未干燥立即用来配制溶液 |
| C、定容时俯视刻度线 |
| D、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A、滴入甲基橙显红色的溶液中:Na+、NO3-、I-、SO42- | ||
| B、水电离的c(H+)=10-12mol/L的溶液中:K+、AlO2-、CH3COO-、SiO32- | ||
C、
| ||
| D、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |


 )
)