题目内容
19.下列物质的鉴别方法不正确的是( )| A. | 用焰色反应鉴别NaCl、KCl | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用稀硫酸鉴别SiO2与Al2O3固体 | |
| D. | 用氢氧化钙溶液鉴别Na2CO3和NaHCO3两种溶液 |
分析 A.Na、K的焰色反应现象不同;
B.氯化铝与氢氧化钠反应生成氢氧化铝,氢氧化铝可溶于氢氧化钠溶液;
C.氧化铝溶于稀硫酸;
D.Na2CO3和NaHCO3都与氢氧化钙溶液反应生成沉淀.
解答 解:A.NaCl的焰色反应现象为黄色,K的焰色反应现象为紫色,可鉴别,故A正确;
B.氯化镁与氢氧化钠反应生成白色沉淀,氯化铝与氢氧化钠反应生成氢氧化铝,氢氧化铝可溶于氢氧化钠溶液,可鉴别,故B正确;
C.氧化铝溶于稀硫酸,二氧化硅不反应,可鉴别,故C正确;
D.Na2CO3和NaHCO3都与氢氧化钙溶液反应生成沉淀,应用氯化钙鉴别,故D错误.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重元素化合物性质的考查,注意把握性质的差异为解答的关键,注重基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
10.下列各组离子中,在溶液里能大量共存,且溶液为无色透明的是( )
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、SiO32-、NO3-、Fe3+ | ||
| C. | Na+、MnO4-、K+、SO42- | D. | Na+、HCO3-、SO42-、Al3+ |
7.下列实验中,依据实验操作及现象,得出的结论不正确的是( )
| 操 作 | 现 象 | 结 论 | |
| A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化 但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| C | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中可能含有 CO32-或 HCO3- |
| A. | A | B. | B | C. | C | D. | D |
14.肼(N2H4)是一种重要的工业产品.资料表明,氨和次氯酸钠溶液反应能生成肼.相关物质的物理性质如下:
某学生对NH3与NaClO的反应进行实验探究:
(1)NaClO溶液呈碱性的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| Ⅰ | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| Ⅱ | 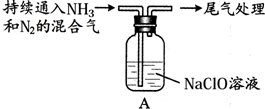 | 液面上方出现白雾 |
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
4.根据有机化合物的命名原则,下列命名正确的是( )
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 2-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
11.高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.干法、湿法制备高铁酸盐的原理如下表所示.
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为3:1.
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①反应Ⅰ的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
②反应Ⅱ的化学方程式为3NaClO+10NaOH+2Fe(NO3)3=2Na2FeO4+3NaCl+6NaNO3+5H2O.
③加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为,它能净水的原因是高铁酸钾有强氧化性,高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性使水澄清.
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①反应Ⅰ的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
②反应Ⅱ的化学方程式为3NaClO+10NaOH+2Fe(NO3)3=2Na2FeO4+3NaCl+6NaNO3+5H2O.
③加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为,它能净水的原因是高铁酸钾有强氧化性,高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性使水澄清.
8.下列离子方程式不正确的是( )
| A. | 向NaClO溶液中滴入少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O | |
| B. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | Na2SO3溶液中SO32-的水解:SO32-+H2O$\frac{\underline{\;电解\;}}{\;}$HSO3-+OH- |
13.从图中表示的各物质能量变化推断下列热化学方程式正确的是(a、b均为正数)( )

| A. | 4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol | |
| B. | 4P(红磷)+5O2(g)═2P2O5(S);△H2=-(b)kJ/mol | |
| C. | 4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol | |
| D. | P(白磷)═P(红磷);△H4=+(a)kJ/mol |