题目内容
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.(1)D元素在元素周期表中的位置为第
(2)下列叙述正确的是
a.水的沸点比M高得多,是因为水分子间能形成氢键,而M分子间不能形成氢键
b.M的中心原子采用sp3杂化
c.N分子中含有6个σ键和1个大π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)已知C2D是一种麻醉剂,根据等电子原理可推知C2D的空间构型为
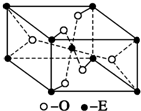
(4)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外成对电子对数与未成对电子数之比为3:2,则D为O元素,所以C为N元素;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为甲醛,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N为苯,E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,为Ti元素,据此答题.
解答:
解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外成对电子对数与未成对电子数之比为3:2,则D为O元素,所以C为N元素;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为甲醛,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N为苯,E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,为Ti元素,
(1)D为氧元素,在元素周期表中的位置为第二 周期 VIA族,故答案为:二;VIA;
(2)a.水的沸点比甲醛高得多,是因为水分子间能形成氢键,而甲醛分子间不能形成氢键,故正确;
b.甲醛的中心原子碳原子的价层电子对数为
=3,所以碳原子采用sp2杂化,故错误;
c.苯分子中含有12个σ键和1个大π键,故错误;
d.CO2晶体是分子晶体,所以它的熔点、沸点都比原子晶体二氧化硅的低,故正确;
故选ad;
(3)N2O与CO2是互为等电子体,根据等电子体原理可知,它们的结构相似,所以N2O的空间构型为直线形,
故答案为:直线形;
(4)由晶胞结构,根据均摊法可知,晶胞中Ti元素数目为1+8×
=2,O原子数目为2+4×
=4,故该氧化物的化学式为TiO2,
故答案为:TiO2.
(1)D为氧元素,在元素周期表中的位置为第二 周期 VIA族,故答案为:二;VIA;
(2)a.水的沸点比甲醛高得多,是因为水分子间能形成氢键,而甲醛分子间不能形成氢键,故正确;
b.甲醛的中心原子碳原子的价层电子对数为
| 4+2 |
| 2 |
c.苯分子中含有12个σ键和1个大π键,故错误;
d.CO2晶体是分子晶体,所以它的熔点、沸点都比原子晶体二氧化硅的低,故正确;
故选ad;
(3)N2O与CO2是互为等电子体,根据等电子体原理可知,它们的结构相似,所以N2O的空间构型为直线形,
故答案为:直线形;
(4)由晶胞结构,根据均摊法可知,晶胞中Ti元素数目为1+8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:TiO2.
点评:本题主要考查了化学键、晶体的性质、分子构型、晶胞计算,中等难度,解题关键在于元素推断.

练习册系列答案
相关题目
下列气体不能用排空气法收集的是( )
| A、O2 |
| B、CO2 |
| C、NO |
| D、NH3 |
下列说法正确的是( )
| A、化学反应中的能量变化,只表现为热量的变化 |
| B、煤和石油属于可再生能源 |
| C、汽车排出大量尾气中含有CO会污染大气 |
| D、要使燃料燃烧只需要大量的氧气 |
氧化还原反应的实质是( )
| A、化合价升降 |
| B、电子得失 |
| C、共用电子对的偏移 |
| D、电子转移 |
在反应CuO+CO
Cu+CO2中,作氧化剂的是( )
| ||
| A、CuO |
| B、CO |
| C、Cu |
| D、CO2 |
有Na2SO4和Al2(SO4)3的混合溶液,已知其中 c(Al3+)=0.4mol/L,c(SO42-)=0.7mol/L,则此溶液中c(Na+)为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.15mol/L |
| D、0.25mol/L |
用NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A、将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B、1mol氧元素组成的单质一定含有2NA氧原子 |
| C、在H2O2+Cl2=2HCl+O2反应中,毎生成32g氧气,则转移2NA个电子 |
| D、含NA个Na+的 Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |