题目内容
有Na2SO4和Al2(SO4)3的混合溶液,已知其中 c(Al3+)=0.4mol/L,c(SO42-)=0.7mol/L,则此溶液中c(Na+)为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.15mol/L |
| D、0.25mol/L |
考点:物质的量浓度的相关计算
专题:
分析:溶液呈电中性,根据电荷守恒有:3c(Al3+)+c(Na+)=2c(SO42-),据此计算c(Na+).
解答:
解:溶液呈电中性,根据电荷守恒有:3c(Al3+)+c(Na+)=2c(SO42-),
即3×0.4mol/L+c(Na+)=2×0.7mol/L,
解得c(Na+)=0.2mol/L,
故选B.
即3×0.4mol/L+c(Na+)=2×0.7mol/L,
解得c(Na+)=0.2mol/L,
故选B.
点评:本题考查物质的量浓度计算,难度不大,注意电解质混合溶液中常利用电荷守恒计算离子浓度.

练习册系列答案
相关题目
下列实验问题的处理方法中,正确的是( )
| A、实验中不慎打破温度计,可用吹风机加快水银(Hg)的蒸发 |
| B、在气体发生装置上直接点燃甲烷(CH4)气体时,必须先检验甲烷的纯度 |
| C、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| D、NH3极易溶于水,制取NH3的实验中,将多余NH3用导管直接导入水槽,用水吸收 |
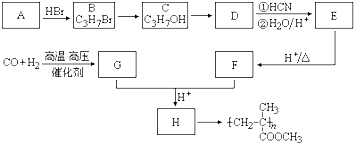
如图是一种综合处理SO2废气的工艺流程.下列说法正确的是( )


| A、向B溶液中滴加KSCN溶液,溶液一定会变为血红色 |
| B、此工艺优点之一是物质能循环使用 |
| C、溶液酸性A>B>C |
| D、溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:则下列表述正确的是( )
| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 25 | 15 | 1 | 5 |
| 反应后质量(g) | 11 | 未测 | 1 | 22 |
| A、该反应是复分解反应 |
| B、丙一定是催化剂 |
| C、乙全部发生了反应 |
| D、甲与乙反应的质量比为14:3 |
下列离子方程式书写正确的是( )
| A、浓NaOH溶液与浓CaCl2溶液混合:Ca2++2OH-=Ca(OH)2↓ |
| B、氯化铝溶液中滴加氨水生成沉淀:Al3++3OH-=Al(OH)3↓ |
| C、利用醋酸溶解含碳酸钙的水垢CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、NaHSO4溶液中滴加NaHCO3溶液:2H++CO32-=CO2↑+H2O |
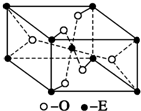 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.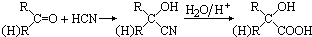 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: