题目内容
现有0.27kg质量分数为10%的CuCl2溶液,计算:
①CuCl2的摩尔质量为 ;
②该溶液中CuCl2的物质的量 ;
③往该溶液中加入2.5mol/L 的AgNO3溶液与CuCl2溶液充分反应,使CuCl2恰好反应完全,需要AgNO3溶液 mL;将反应后所得溶液加水稀释至1000mL,则所得溶液的物质的量浓度为 .
①CuCl2的摩尔质量为
②该溶液中CuCl2的物质的量
③往该溶液中加入2.5mol/L 的AgNO3溶液与CuCl2溶液充分反应,使CuCl2恰好反应完全,需要AgNO3溶液
考点:物质的量的相关计算
专题:
分析:CuCl2的摩尔质量为135g/mol,根据n=
计算物质的量,反应的方程式为CuCl2+2AgNO3=AgCl↓+Cu(NO3)2,结合反应的方程式计算.
| m |
| M |
解答:
解:(1)CuCl2的摩尔质量为135g/mol,数值上等于相对分子质量,故答案为:135g/mol;
(2)m(CuCl2)=270g×10%=27g,
n=
=
=0.2mol,
故答案为:0.2mol;
(3)反应的方程式为CuCl2+2AgNO3=AgCl↓+Cu(NO3)2,
由方程式可知,反应0.2molCuCl2,需要0.4molAgNO3,生成0.2molCu(NO3)2,
则V(溶液)=
=0.16L=160mL,
将反应后所得溶液加水稀释至1000mL,则所得溶液的物质的量浓度为
=0.2mol/L,
故答案为:160;0.2mol/L.
(2)m(CuCl2)=270g×10%=27g,
n=
| m |
| M |
| 27g |
| 135g/mol |
故答案为:0.2mol;
(3)反应的方程式为CuCl2+2AgNO3=AgCl↓+Cu(NO3)2,
由方程式可知,反应0.2molCuCl2,需要0.4molAgNO3,生成0.2molCu(NO3)2,
则V(溶液)=
| 0.4mol |
| 2.5mol/L |
将反应后所得溶液加水稀释至1000mL,则所得溶液的物质的量浓度为
| 0.2mol |
| 1L |
故答案为:160;0.2mol/L.
点评:本题考查物质的量浓度的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意结合反应的方程式计算该题,难度不大.

练习册系列答案
相关题目
高分子化合物的结构如下: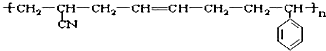 其单体可能是( )
其单体可能是( )
①CH2=CHCN;②乙烯;③1,3-丁二烯;④苯乙炔;⑤苯乙烯;⑥1-丁烯.
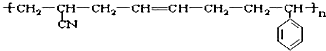 其单体可能是( )
其单体可能是( )①CH2=CHCN;②乙烯;③1,3-丁二烯;④苯乙炔;⑤苯乙烯;⑥1-丁烯.
| A、①③⑤ | B、②③⑤ |
| C、①②⑥ | D、①③④ |
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是( )
| A、NaNO2在反应中被氧化 |
| B、NaI是还原产物 |
| C、若反应过程中转移2mole-,则生成标准状况下NO的体积为44.8L |
| D、氧化剂与还原剂之比为1:2 |
血液化验单中“葡萄糖”一项的结果为4.94×10-3 mol?L-1.这里的“4.94×10-3 mol?L-1”表示葡萄糖的( )
| A、物质的量 | B、摩尔质量 |
| C、质量分数 | D、物质的量浓度 |
下列有关化学用语表示正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、羟基的电子式: |
C、甲烷分子的比例模型: |
D、乙醇的结构式: |
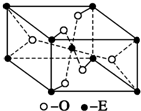 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:2.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.