题目内容
3.C+CO2?2CO,该反应吸收热量,反应速率为v1;N2+3H2?2NH3,该反应放出热量,反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )| A. | 同时增大 | B. | 同时减小 | C. | 增大,减小 | D. | 减小,增大 |
分析 化学反应无论是吸热反应还是放热反应,温度升高,化学反应速率都增大,以此解答该题.
解答 解:化学反应无论是吸热反应还是放热反应,温度升高,活化分子的百分含量增大,有效碰撞的次数增大,化学反应速率都增大.
故选:A.
点评 本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,题目难度不大,注意温度对反应速率的影响.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
11.下列图示与对应的叙述相符的是( )


| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1>T2 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
14.有aA3+和bBn-两种离子,它们的电子层结构相同,则n值是( )
| A. | a-3-b | B. | b-3-a | C. | a+3-b | D. | a-3+b |
11.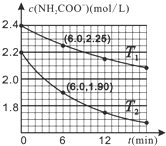 已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
 已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )| A. | 无法判断T1和T2的大小关系 | |
| B. | T1℃时,第6min反应物转化率为6.25% | |
| C. | T2℃时,0~6min ν(NH2COO-)=0.3mol•L-1•min-1 | |
| D. | 往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
8.下列说法中正确的是( )
| A. | 元素的种类由原子的质量数决定 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素所形成的所有含氧酸的酸性从左到右一定依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
12.一定条件下,下列所发生的反应属于取代反应的是( )
| A. | 天然气的燃烧 | B. | 乙烯使溴水褪色 | ||
| C. | 苯与浓硝酸反应 | D. | 溴乙烷与氢氧化钠的醇溶液反应 |
13.除去下列杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | 溴水 | 洗气 |
| B | C6H6(Br2) | NaOH溶液 | 分液 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.
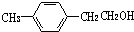 ,F的分子式C9H10.
,F的分子式C9H10.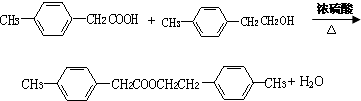 .
.