题目内容
12.下列叙述中不正确的是( )| A. | C、N、O三种元素的氢化物稳定性依次减弱 | |
| B. | Mg、Al、Si三种元素的原子半径依次减小 | |
| C. | F、Cl、Br三种元素的非金属性依次减弱 | |
| D. | Li、Na、K三种元素的最高价氧化物对应水化物碱性依次增强 |
分析 A.非金属性越强,对应氢化物越稳定;
B.同周期从左向右原子半径减小;
C.同主族从上到下非金属性减弱;
D.金属性越强,对应最高价氧化物对应水化物碱性越强.
解答 解:A.非金属性越强,对应氢化物越稳定,则C、N、O三种元素的氢化物稳定性依次增强,故A错误;
B.同周期从左向右原子半径减小,则Mg、Al、Si三种元素的原子半径依次减小,故B正确;
C.同主族从上到下非金属性减弱,则F、Cl、Br三种元素的非金属性依次减弱,故C正确;
D.金属性越强,对应最高价氧化物对应水化物碱性越强,则Li、Na、K三种元素的最高价氧化物对应水化物碱性依次增强,故D正确;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
15.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | 分散质粒子直径与分散系种类: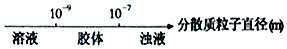 | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: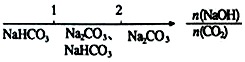 | |
| C. | AlCl3溶液中滴加NaOH溶液后铝的存在形式: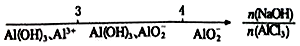 | |
| D. | Na与O2反应的产物: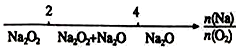 |
20.要除去下列四种物质中的少量杂质(括号内物质为杂质).
甲:炭粉(氧化铜) 乙:NaOH(Na2CO3) 丙:KCl(KHCO3) 丁:CaCO3(Na2CO3)
可选用的试剂及操作方法有:
①加适量盐酸,搅拌,过滤; ②加适量水,搅拌,过滤③加适量盐酸,蒸发; ④溶解,加适量石灰水,过滤,蒸发
下列组合正确的是( )
甲:炭粉(氧化铜) 乙:NaOH(Na2CO3) 丙:KCl(KHCO3) 丁:CaCO3(Na2CO3)
可选用的试剂及操作方法有:
①加适量盐酸,搅拌,过滤; ②加适量水,搅拌,过滤③加适量盐酸,蒸发; ④溶解,加适量石灰水,过滤,蒸发
下列组合正确的是( )
| A. | 甲-②,乙-④ | B. | 乙-③,丙-③ | C. | 乙-④,丁-② | D. | 丙-①,丁-② |
17.下列说法正确的是( )
| A. | 二氧化碳溶于水能部分电离,故二氧化碳属于电解质 | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 氯化钠溶液在电流作用下完全电离成钠离子和氯离子 | |
| D. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 |
1.在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
| A. | 上述生成Ni(CO)4(g)的反应为吸热反应 | |
| B. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v正<v逆 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3 COO-、Fe2+ | |
| B. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(FeCl3)=1.0mol/L的溶液中:HCO3-、Cl-、H+、Na+ |