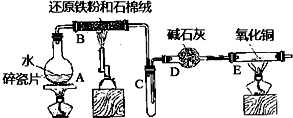
题目内容
20.某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
在圆底烧瓶中加入3mL浓硫酸、12.2g苯甲酸、20mL甲醇(密度约为0.79g/cm3).
(1)液体混合时,正确的加入顺序是先加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸.
(2)为防止圆底烧瓶中的液体在实验时发生暴沸,在加热前应采取的措施是加入沸石或碎瓷片.
(3)在该反应中反应物甲醇应过量,其理由是该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,故可增加甲醇的量,以提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(4)现拟用下列流程精制苯甲酸甲酯,请根据流程图填入恰当操作方法的名称:操作1为分液,操作2为蒸馏.
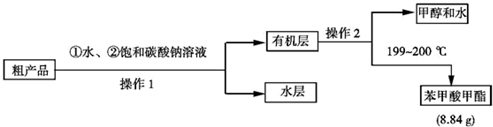
(5)苯甲酸甲酯的产率为65%.
(6)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,某同学做了如下检验.
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
分析 (1)溶液混合时,将密度大的液体倒入密度小的液体中;
(2)蒸馏时沸石或碎瓷片起防暴沸的作用;
(3)增大一种反应物的物质的量,能增大另一种物质的转化率;
苯甲酸甲酯中含有苯甲酸和甲醇,苯甲酸和甲醇易溶于水,苯甲酸甲酯不易溶于水,饱和碳酸钠能吸收甲醇且能和苯甲酸分液生成可溶性的苯甲酸钠,苯甲酸甲酯不反应,然后分液得到水层和有机层,有机层中含有苯甲酸甲酯和甲醇,然后利用蒸馏方法得到苯甲酸甲酯、甲醇和水;
(4)分离互不相溶的液体采用分液方法,分离互溶的液体采用蒸馏方法;
(5)n(甲醇)=$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol,n(苯甲酸)=$\frac{12.2g}{122g/mol}$=0.1mol<0.49mol,则甲醇过量,根据苯甲酸与苯甲酸甲酯关系式知,理论上生成0.1mol苯甲酸甲酯,其质量=0.1mol×136g/mol=13.6g,其产率=$\frac{实际质量}{理论质量}$×100%;
(6)水能使无水硫酸铜由白色变为蓝色,所以可以用无水硫酸铜检验水蒸气;
硫酸能和氯化钡反应生成难溶性的硫酸钡沉淀,可以用氯化钡溶液检验硫酸.
解答 解:(1)溶液混合时,将密度大的液体倒入密度小的液体中,苯甲酸和甲醇密度都小于浓硫酸,所以混合溶液先后顺序是先加入12.2 g苯甲酸和20 mL甲醇,再小心加入3 mL浓硫酸,故答案为:先加入12.2 g苯甲酸和20 mL甲醇,再小心加入3 mL浓硫酸;
(2)蒸馏时沸石或碎瓷片起防暴沸的作用,为防止溶液暴沸,所以在加热前需要加入沸石或碎瓷片,
故答案为:加入几粒沸石或碎瓷片;
(3)增大一种反应物的物质的量,能增大另一种物质的转化率,所以甲醇的量较多时能提高苯甲酸的转化率,且甲醇沸点低易损伤,甲醇比苯甲酸廉价,
故答案为:该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,故可增加甲醇的量,以提高苯甲酸的转化率;
苯甲酸甲酯中含有苯甲酸和甲醇,苯甲酸和甲醇易溶于水,苯甲酸甲酯不易溶于水,饱和碳酸钠能吸收甲醇且能和苯甲酸分液生成可溶性的苯甲酸钠,苯甲酸甲酯不反应,然后分液得到水层和有机层,有机层中含有苯甲酸甲酯和甲醇,然后利用蒸馏方法得到苯甲酸甲酯、甲醇和水;
(4)分离互不相溶的液体采用分液方法,分离互溶的液体采用蒸馏方法,所以操作①是分液、操作②是蒸馏,
故答案为:分液;蒸馏;
(5)n(甲醇)=$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol,n(苯甲酸)=$\frac{12.2g}{122g/mol}$=0.1mol<0.49mol,则甲醇过量,根据苯甲酸与苯甲酸甲酯关系式知,理论上生成0.1mol苯甲酸甲酯,其质量=0.1mol×136g/mol=13.6g,其产率=$\frac{实际质量}{理论质量}$×100%=$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%;
(6)水能使无水硫酸铜由白色变为蓝色,所以可以用无水硫酸铜检验水蒸气,其检验方法是:取适量产品置于试管中,加入适量无水硫酸铜,如果固体变蓝色,则说明产品中含有水,否则不含水;
硫酸能和氯化钡反应生成难溶性的硫酸钡沉淀,可以用氯化钡溶液检验硫酸,其检验方法是:取适量产品置于试管中,加入适量氯化钡溶液,如果有白色沉淀生成,则说明产品中含有硫酸,否则不含硫酸,
故答案为:
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是:取适量产品置于试管中,加入适量无水硫酸铜 | ,如果固体变蓝色,则说明产品中含有水,否则不含水 |
| 检验粗产品中含有硫酸的操作是:取适量产品置于试管中,加入适量氯化钡溶液 | 如果有白色沉淀生成,则说明产品中含有硫酸,否则不含硫酸 |
点评 本题考查物质制备,为高频考点,涉及实验基本操作、方程式计算、物质检验、物质分离和提纯,明确实验原理、实验基本操作方法、物质性质等知识点是解本题关键,注意(1)中溶液滴加先后顺序,为易错点.

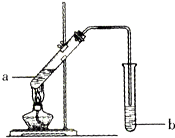 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是:防止倒吸.
(3)试管b中饱和Na2CO3的作用:除去挥发出来的乙酸和乙醇;降低乙酸乙酯的溶解度,有利于分层.
(4)开始用小火加热试管a中的混合液,其原因是乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(5)生成乙酸乙酷的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酷化反应已达到化学平衡状态的有②④⑤(填序号).
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成I mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(6)若120g乙酸和184g乙醇反应生成106g乙酸乙酯,则该反应的产率为60.2%(保留三位有效数字).
 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:ⅠCO(g)+2H2(g)?CH3OH(g)△H1
ⅡCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
ⅢCO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合-反应物标准生成热总和.
已知四种物质的标准生成热如表:
| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
B.△H3>0(填=、<、>)
(2)由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).实验数据见表:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
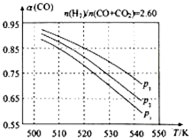
(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
①α(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.
②图中P1、P2、P3的大小关系为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高.
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:装置简单,减小了电池的体积;若以硫酸作为电解质其负极反应为:CH3OH-6e-+H2O=CO2+6H+.
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
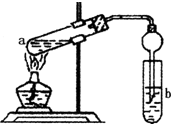 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.